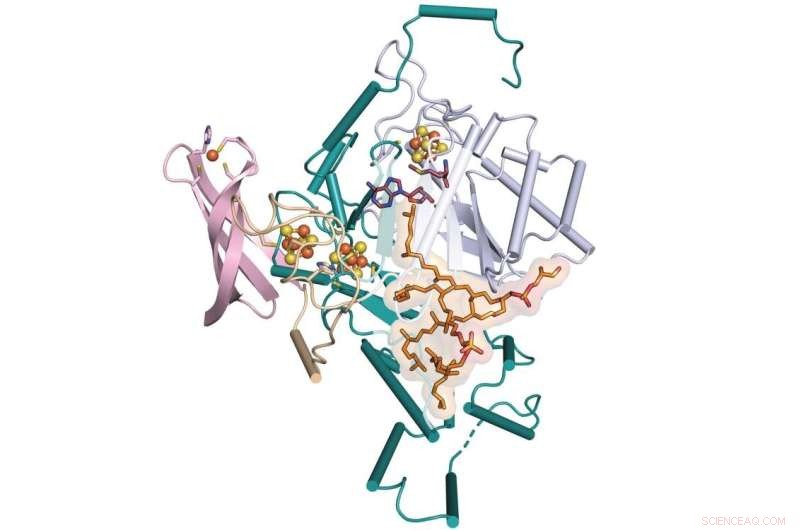
Ett team från Penn State och University of Illinois Urbana-Champaign har fastställt det saknade steget i bildandet av en molekyl som kallas GDGT, som är en lovande kandidat för användning som en indikator på tidigare klimat. Teamet fastställde röntgenkristallstrukturen för ett enzym som underlättar denna process som kallas GDGT/MAS – som här visas bundet till ytterligare kofaktorer. Kredit:Booker Lab / Penn State
Det saknade steget i bildandet av en lipidmolekyl som gör att vissa encelliga organismer kan överleva de mest extrema miljöerna på jorden har nu dechiffrerats. Denna nya förståelse, avslöjad av ett team av biokemister från Penn State och University of Illinois Urbana-Champaign, kan förbättra lipidernas förmåga att användas som en indikator på temperatur över geologisk tid.
Lipiden, som kallas glyceroldibifytanylglyceroltetraeter (GDGT), finns i cellmembranet hos vissa arter av arkéer, encelliga organismer som ursprungligen troddes vara bakterier men som nu anses vara en separat grupp. Denna lipid ger stabilitet för vissa arter att frodas i miljöer med extremt höga temperaturer, salthalt eller surhet, som termiska öppningar i havet, varma källor och hypersaltvatten. Den unika stabiliteten hos GDGT tillåter också att den upptäcks hundratals eller till och med tusentals år efter att organismen dör. Eftersom dessa organismer tenderar att producera mer GDGT vid högre temperaturer anses det vara en lovande kandidat för att uppskatta temperatur över geologisk tid.
"För att GDGT ska kunna användas korrekt som en proxy för att rekonstruera förändringar i geologiska temperaturer måste forskare bättre förstå hur det är tillverkat, vilka gener som kodar för det och vilka arter som kan skapa det", säger Squire Booker, biokemist vid Penn State , en utredare vid Howard Hughes Medical Institute och ledare för forskargruppen. "Men fram till nu har det saknats ett steg i bildningen av denna lipid. Vi använde avbildningstekniker i kombination med kemiska och biokemiska metoder för att dekonstruera den kemiska vägen för detta saknade steg."
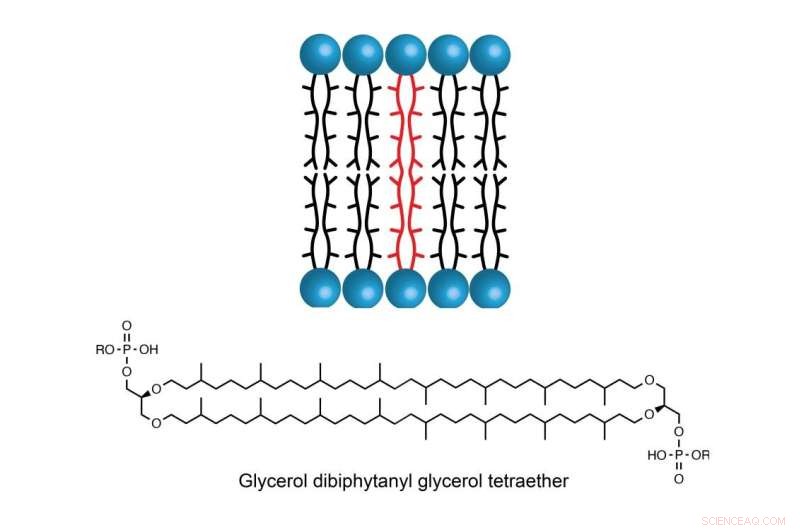
Molekylen GDGT finns i cellmembranet hos vissa arter av archaea, vilket gör att de encelliga organismerna kan frodas i miljöer med extremt höga temperaturer, salthalt eller surhet. Kredit:Booker Lab / Penn State
GDGT:s stabilitet beror delvis på dess två långa kolvätekedjor som sträcker sig genom membranet. Men hur dessa två kedjor blir sammanlänkade har förbryllat forskare i årtionden.
"Att koppla ihop kolen i slutet av de två kolvätekedjorna är verkligen en utmanande kemi eftersom de är inerta - de är kemiskt inaktiva", säger Cody Lloyd, doktorand vid Penn State och medlem av forskargruppen. "Vi identifierade enzymet som aktiverar dessa terminala kol och gör denna koppling möjlig. Dessutom känner vi nu till genen som kodar för detta enzym, vilket borde förbättra användningen av GDGT som en indikator på tidigare klimat."
Enzymet som underlättar kopplingen av de två kolvätekedjorna tillhör en klass av proteiner som kallas radikala SAM-proteiner, som är kända för att spela en viktig roll i en mängd olika kemiska reaktioner, inklusive produktion av antibiotika, modifiering av proteiner, DNA och RNA och skapandet av olika biomolekyler.
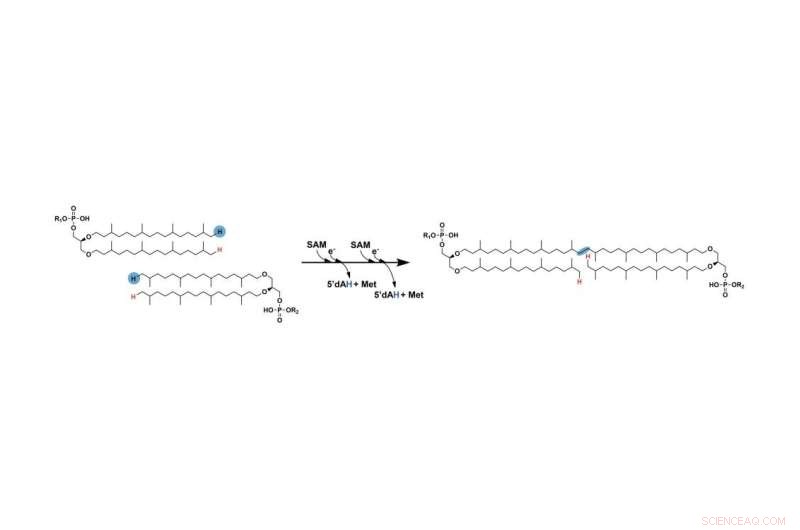
Det tidigare saknade steget i bildandet av GDGT innebär att två långa kolvätekedjor kopplas samman. De två väten markerade med blått avlägsnas slutligen, och kedjorna ansluter slutligen på de ställen där dessa atomer togs bort. Ett radikalt SAM-enzym underlättar denna process. Kredit:Booker Lab / Penn State
Det första steget liknar det för andra reaktioner som involverar radikala SAM-enzymer:radikala SAM-enzymet använder ett av sina järn-svavelkluster för att klyva en molekyl som heter S-adenosyl-L-metionin (SAM), och producerar en "fri radikal". eller en oparad elektron som är mycket reaktiv och hjälper till att föra reaktionen framåt. Sedan plockar radikalen en väteatom från kolet i slutet av kedjan. Vid ett senare steg upprepas denna process med den andra kedjan med användning av en andra molekyl av SAM.
"I slutändan slutar kolen i slutet av var och en av kedjorna att binda till varandra vid den position där väteatomerna avlägsnades", sa Lloyd. "Men när vätet på den första kedjan väl har tagits bort blir det så instabilt att det kan reagera med i stort sett vad som helst. För att tillfälligt hindra den första kedjan från att reagera med några off-mål binder kolet till en svavelatom från en annan av enzymets tre järn-svavelkluster."
När vätet väl har avlägsnats från den andra kedjan, uppmuntrar den resulterande radikalen den första kedjan att ta bort sig själv från järn-svavelklustret på enzymet och istället binda till den andra kedjan. Detta resulterar i att de två kedjorna binds samman, vilket fullbordar det saknade steget i GDGT:s bildande. Forskarna presenterar sina resultat i en artikel som visas online och i tryck i numret 1 september av tidskriften Nature .
"Detta är en helt ny användning av ett järn-svavelkluster, och det här är det första exemplet i naturen på kopplingen av två helt inerta kolatomer med denna elektronkonfiguration, som kemister kallar sp3 hybridiserad", säger Booker. "Det har funnits ett stort intresse för att skapa den här typen av kol-kolbindningar från sp3-hybridiserade kol som en del av läkemedel och andra industriprodukter. Naturen har haft miljontals år på sig att ta reda på det här, så vi fortsätter att titta på naturen för inspiration för syntetiska reaktioner - som denna nya användning av ett järn-svavelkluster." + Utforska vidare