
Figur 1. En ny teknik för att observera levande cellmembran för AFM med hjälp av poröst kiselnitridmembran (MPM). (a) MPM:s utseende. (b) Hålen i MPM observerade av AFM. (c) MPM när den ställs in i kammaren för observation. (d) Schematisk beskrivning av AFM-cellytobservation med användning av MPM. Kredit:Kanazawa University
Forskare vid Kanazawa University rapporterar i Communications Biology att användning av vanliga kemikalier för att fixera levande cellprover för mikroskopistudier får membranproteiner att aggregera.
För histologiska undersökningar av biologiska vävnader, det vill säga anatomiska studier under mikroskop, fixeras vanligtvis prover för att förhindra att de förfaller. Fixering görs vanligtvis genom att nedsänka eller perfundera provet i en kemikalie - aldehyder och alkoholer är vanliga fixativ. Det har spekulerats i att membranproteiner som rör sig i viss utsträckning på ett cellmembran kan bilda aggregat under fixering. Ändå är detaljerade cellytestudier med upplösning i nanometerskala nödvändiga för att få definitiva insikter i denna potentiella fråga. Nu har Takehiko Ichikawa och kollegor från Kanazawa University utfört atomic force microscopy (AFM) studier av levande däggdjurscellytor. Genom att jämföra icke-fixerade och fixerade prover fann de att fixering verkligen leder till strukturella förändringar.
Forskarna utvecklade en metod för att använda mikroporöst kiselnitridmembran (MPM), som används i transmissionselektronmikroskopi (Figur 1), för AFM-avbildning. Viktigt är att MPM kan göra cellytan platt och förhindra fluktuationer genom att stödja området utanför observationsområdet. I AFM-bilder av ytorna på de odlade tjocktarmscancercellerna på MPM, visade sig biomolekylära strukturer på cellmembranen som utsprång med en typisk storlek på några nanometer (Figur 2 levande cellyta).
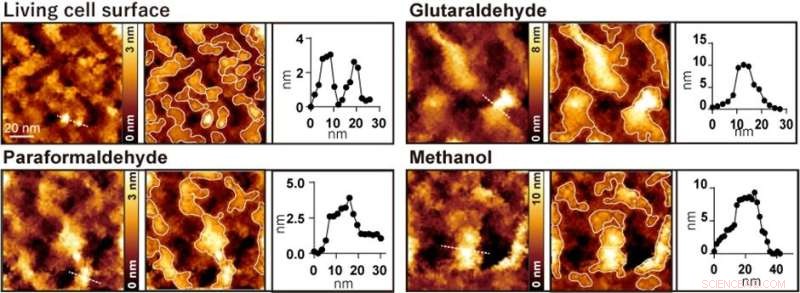
Figur 2. Observation av AFM-cellytan före och efter behandling med glutaraldehyd, paraformaldehyd respektive metanol. Den vänstra bilden är en AFM-bild, den mittersta bilden är en AFM-bild med utsprången inramade och den högra bilden är en höjdprofil längs den prickade linjen i den vänstra bilden. Kredit:Kanazawa University
När cellerna behandlades med vanliga fixeringsmedel som paraformaldehyd, glutaraldehyd och metanol försvann några nanometerstrukturer och endast stora utsprång med diametrar från 20 till 100 nanometer observerades (Figur 2). Forskarna utförde flera fluorescensexperiment och drog slutsatsen att stora utsprång som observerades efter fixering bildades genom aggregering av membranproteiner.
Studien visar att de observerade aggregaten är artefakter som härrör från fixeringsprocessen. Detta bör mana till försiktighet bland forskare som arbetar med kemiska fixeringsmedel. Citerar Ichikawa och kollegor:"Forskare som observerar nanoskalakluster bör också vara försiktiga med att tolka sina experimentella resultat när de använder fixerade celler. Vi rekommenderar att forskare använder levande celler så mycket som möjligt för att undvika effekten av fixering när de undersöker nanoskalakluster."
Den allmänna principen bakom atomkraftsmikroskopi (AFM) är att få en mycket liten spets att skanna ytan på ett prov. Under denna horisontella (xy) skanning följer spetsen, som är fäst vid en liten konsol, provets vertikala (z) profil, vilket inducerar en kraft på konsolen som kan mätas. Storleken på kraften vid xy-positionen kan relateras till z-värdet; xyz-data som genereras under en skanning resulterar sedan i en höjdkarta som ger strukturell information om det undersökta provet. AFM påverkas inte av diffraktionsgränsen på grund av användningen av ljus eller elektronstrålar och kan observera den intakta yttopografin med hög upplösning. + Utforska vidare