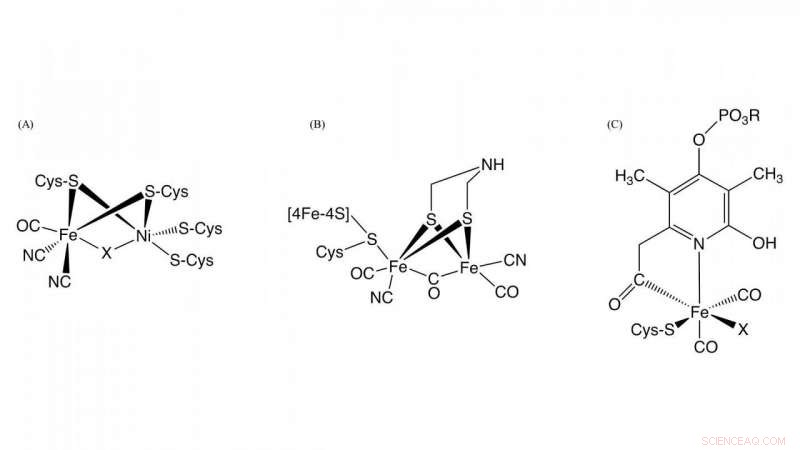
Figur 1. Struktur för de aktiva platserna i [NiFe]-hydrogenas, [FeFe]-hydrogenas, och [Fe]-hydrogenas Kredit:NINS/IMS
En forskargrupp som inkluderar forskare från Exploratory Research Centre on Life and Living Systems (ExCELLS), Institutet för molekylär vetenskap (IMS) vid National Institutes of Natural Sciences, och Osaka University har avslöjat den detaljerade mekanismen för biosyntesen av kolmonoxid som är avgörande för mognaden av det aktiva stället för NiFe-hydrogenas.
Hydrogenas, som är ett metalloenzym som ansvarar för oxidation av vätgas och reduktion av protoner, spelar en nyckelroll i bakteriell vätemetabolism. Baserat på skillnaderna i metallinnehåll på den aktiva webbplatsen, de klassificeras i tre grupper:NiFe-, FeFe-, och Fe-hydrogenaser innehållande olika metallkomplex som aktiva centra i dessa enzymer (Figur 1). Även om strukturerna vid de aktiva centra av dem är olika, det är väsentligt för hydrogenasaktivitet att kolmonoxid (CO) koordineras till järnjonen i det aktiva centret. Det är känt att CO biosyntetiseras genom en enzymatisk reaktion, men detaljerna i CO-biosyntesen var okänd.
I denna forskning, gruppen bestämde kristallstrukturen för enzymet (HypX) som ansvarar för biosyntesen av CO (Figur 2), baserat på vilken HypX biosyntetiserar CO genom en aldrig tidigare skådad reaktion för mognad av NiFe-hydrogenas. HypX består av två domäner:de N-terminala och C-terminala domänerna. En kontinuerlig kavitet som förbinder de N- och C-terminala domänerna finns i det inre av HypX (Figur 2). I kristallstrukturen, coenzym A (CoA) är bundet till den C-terminala regionen av kaviteten.
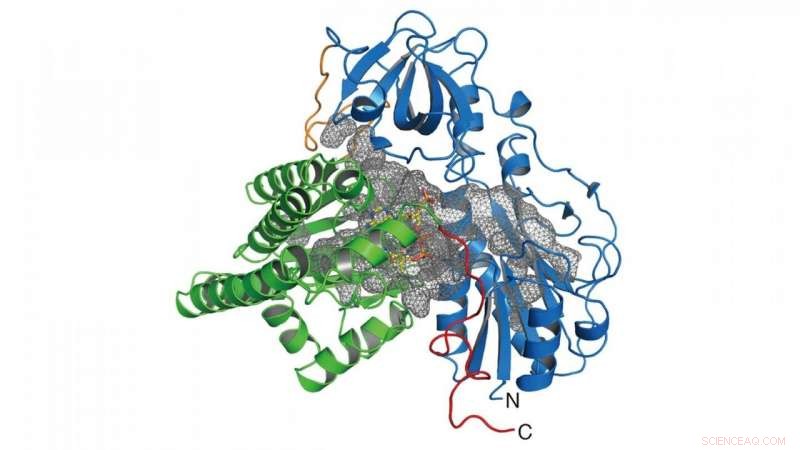
Figur 2. Kristallstruktur för HypX. De N- och C-terminala domänerna visas i blått och grönt, respektive. Kaviteten inuti HypX visas i ett grått nät. Kredit:NINS/IMS
Två olika reaktioner förekommer i de N- och C-terminala domänerna. I den N-terminala domänen, en formylgruppöverföringsreaktion från formyltetrahydrofolat, som är bunden i den N-terminala regionen av kaviteten som ett substrat till CoA, sker (reaktionssteg 1 i fig. 3). Just nu, CoA i kaviteten antar den linjära utökade konformationen, och SH-gruppen av CoA är belägen nära formylgruppen i formyltetrahydrofolatet bundet i den N-terminala domänen. Sedan, formyl-CoA produceras som en reaktionsmellanprodukt genom formyl-gruppöverföringsreaktionen från formyltetrahydrofolat till CoA.
I nästa steg, formyl-CoA genomgår en stor konformationsförändring i kaviteten så att formylgruppen i den terminala positionen av formyl-CoA är belägen på det aktiva stället i den C-terminala domänen av HypX (reaktionssteg 2 i fig. 3). I C-terminaldomänen, CO bildas genom dekarbonylering av formyl-CoA (reaktionssteg 3 i fig. 3).
Denna CO-biosyntesreaktion är den oöverträffade och nya reaktionen. CoA är välkänt som ett koenzym, som har den viktiga rollen i fettsyrametabolism och cellulär energiomsättning genom citronsyracykeln. Dock, det har aldrig rapporterats att CoA/formyl-CoA är involverat i CO-biosyntesreaktioner. Denna forskning har avslöjat en ny fysiologisk funktion hos ett välkänt coenzym CoA.
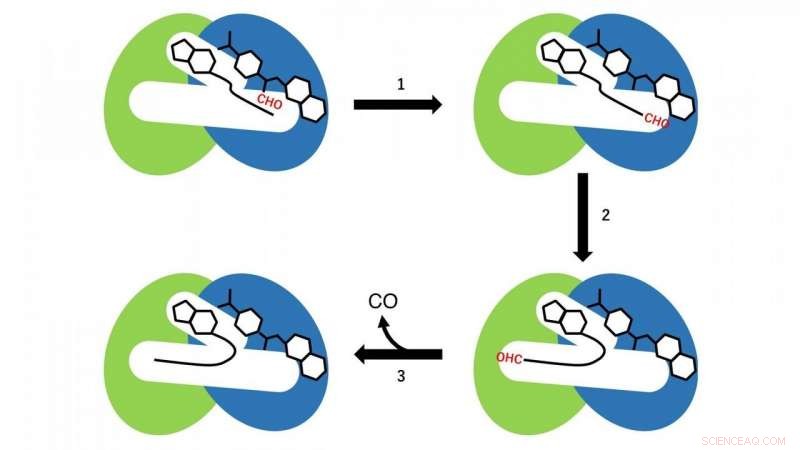
Figur 3. Reaktionsschema för CO-biosyntes genom HypX. De N- och C-terminala domänerna visas i blått respektive grönt. Formyl-grupp (CHO) visas i rött. Kredit:NINS/IMS
Framtida prospekt:
De biosyntetiska mekanismerna för metalloenzymer förblir okända i många fall. Det återstår att belysa särskilt hur de metallinnehållande aktiva centran av metalloenzymer har satts samman. I det här arbetet, vi bestämde den första kristallstrukturen för enzymet som katalyserar den biosyntetiska reaktionen av kolmonoxid som är nödvändig för konstruktionen av det aktiva stället för [NiFe]-hydrogenas. I framtiden, vi kommer att fortsätta forskningen för att belysa den detaljerade mekanismen för hela hydrogenasmognadsvägen baserat på detta resultat.