Ny studie identifierar vesikulär nukleotidtransportör som ett nytt mål för eikosapentaensyra (EPA) och belyser mekanismen bakom den smärtstillande effekten av EPA. EPA dämpar kraftigt neuropatisk och inflammatorisk smärta och insulinresistens, med färre biverkningar. Kredit:Takaaki Miyaji från Okayama University
Eikosapentaensyra (EPA) är ett viktigt näringsämne som tillhör omega-3-gruppen av fleromättade fettsyror (PUFA). Eftersom människokroppen inte kan syntetisera PUFA, krävs kosttillskott som innehåller EPA för normala fysiologiska funktioner. EPA, som finns rikligt i naturliga källor som fisk, hampaolja och linolja, är känt för att uppvisa antiinflammatoriska, neuroprotektiva och kardiovaskulära skyddsaktiviteter.
Dessutom har nya studier visat dess terapeutiska effekter för att minska dödlighetsrisken efter hjärtinfarkt, förbättra insulinresistens, minska blodfettnivåerna och hämma trombocytaggregation. Omega-3 PUFA har också visat sig minska inflammatoriska svar efter COVID-19-infektion. Trots det breda spektrumet av dess terapeutiska effekter förblir de molekylära målen och den underliggande mekanismen för EPA:s verkan svårfångade.
Forskningsprofessor Takaaki Miyaji från Okayama University, Japan, och hans team av forskare har nu avslöjat ett nytt molekylärt mål för EPA i deras senaste arbete publicerat i tidskriften Proceedings of the National Academy of Sciences .
Forskningsprofessor Miyaji, motsvarande författare till denna artikel, förklarar logiken bakom sin studie att "konventionella molekylära mål såsom COX-2-hämmare kan förklara de antiinflammatoriska och smärtstillande effekterna av inflammatorisk smärta, men inte neuropatisk smärta, av EPA Men eftersom EPA avsevärt dämpar både inflammatorisk och neuropatisk smärta, finns det en stor möjlighet att det finns ett annat viktigt molekylärt mål för EPA relaterat till neuropati." Genom att dyka djupare försökte teamet därför förstå verkningsmekanismen för EPA för att lindra både inflammatorisk och neuropatisk smärta.
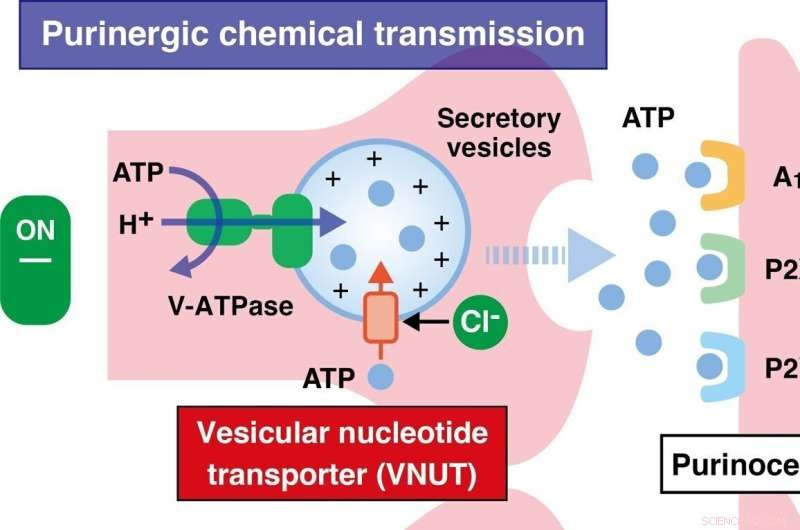
Under neurologiska, metabola och immunologiska störningar leder "purinerg" kemisk överföring (en form av extracellulär signalering som medieras av purinderivat) till bindning av energibärare som adenosintrifosfat (ATP) till "purinoreceptorer", vilket inducerar och förvärrar neuropatiska och inflammatorisk smärtuppfattning. Denna bindning medieras av en vesikulär nukleotidtransportör (VNUT), som därmed blir nyckelmolekylen i initieringen av purinerg signalering. Forskarna antog att EPA är inriktat på VNUT, och därigenom blockerar purinerg kemisk överföring och minskar smärtuppfattningen.
Forskningsprofessor Miyaji och hans team testade denna hypotes både in vitro, med hjälp av mänskligt härledd VNUT, och in vivo, med en VNUT-defekt musmodell.
De fann att EPA konkurrerar med klorjoner som normalt aktiverar VNUT och hämmar VNUT-medierad frisättning av ATP. Dessutom observerade de denna effekt endast med EPA och dess metaboliter, och inte med docosahexaensyra, en annan omega-3-fettsyra, vilket tyder på att strukturen av omega-3-fettsyror med sidokedjor är nödvändig för VNUT-hämning.
Vidare inducerade de neuropatisk smärta hos vildtyps- och VNUT-bristmöss med användning av kemoterapeutiska medel som används vid cancerbehandling. EPA accentuerade särskilt smärta hos vildtypsdjur, men inte hos möss med VNUT-brist, vilket bekräftar deras tidigare upptäckt om den hämmande effekten av EPA på VNUT. På liknande sätt har insulinresistens inducerad av neuropatisk smärta visat sig minska genom EPA-behandling hos vildtyp, men inte hos möss med VNUT-brist.
"Vi fann att låga koncentrationer av EPA fullständigt och reversibelt hämmade frisättningen av ATP från neuroner, utan att hämma frisättningen av andra signalsubstanser. Jämfört med andra läkemedel visade EPA en högre smärtstillande effekt och färre biverkningar", förklarar forskningsprofessor Miyaji.
Dessutom kan neuropatisk smärta och associerad insulinresistens, de smärtstillande effekterna av EPA utökas ytterligare till kronisk smärta associerad med flera andra tillstånd som kemoterapi, diabetes, reumatism, gikt, ischiasnervligation och inflammation. Dessutom är purinerg kemisk överföring också associerad med en mängd olika tillstånd, inklusive Alzheimers sjukdom och depression, för vilka EPA kan utforskas som en terapeutisk strategi.
Dessutom kan opioider och andra smärtstillande mediciner ha långvariga biverkningar och leda till missbruk. I avsaknad av optimala läkemedelsbehandlingar med färre biverkningar leder kronisk smärta till en minskad livskvalitet, förutom att den ökar den ekonomiska bördan av behandlingen. Med denna upptäckt kan "näringsbaserat EPA" och dess metaboliter indikeras vid behandling av kronisk smärta, samtidigt som potentiella biverkningar hålls borta.
Forskningsprofessor Miyaji utvecklar de långsiktiga konsekvenserna av deras forskning och tillägger att deras "resultat kan hjälpa till att utveckla nya näringsämnesbaserade behandlings- och förebyggande strategier genom att inrikta sig på purinerg kemisk överföring för inflammatoriska, neurologiska och metabola sjukdomar, utan de negativa biverkningarna av konventionella smärtstillande mediciner." + Utforska vidare