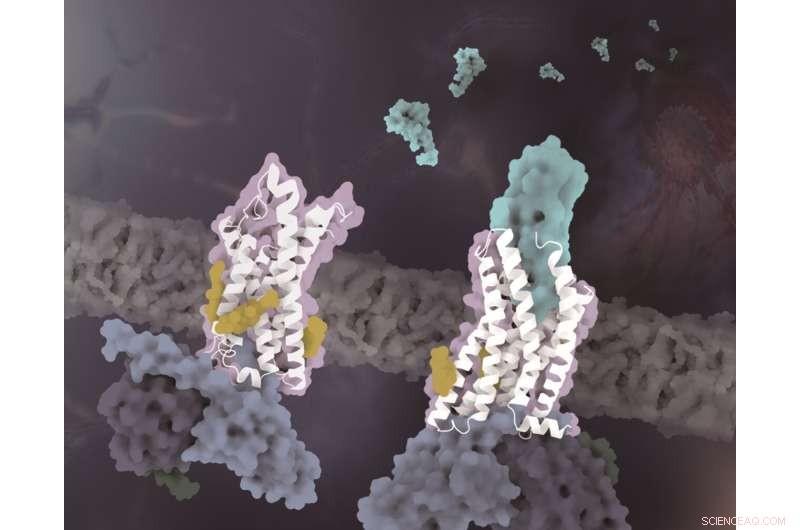
Strukturerna för CX3CR1 i distinkta konformationella tillstånd. CX3CR1 i både ligandfritt tillstånd och CX3CL1-bundet tillstånd är färgade vita. CX3CL1 är färgad cyan, kolesterolerna är färgade gula och de tre subenheterna av G-proteinet är färgade ljusblå, mörkblå respektive mörkgröna. Kredit:Zhao Qiangs laboratorium vid SIMM
Kemokinreceptorer reglerar migrationen av immunceller och är involverade i inflammation, tumörkonstruktion och patogeninfektion. Kemokiner delas in i fyra underfamiljer enligt antalet och fördelningen av konserverade cysteiner vid N-terminalen:CC, CXC, CX3C och XC.
Kemokinerna känner igen sina receptorer i samma underfamilj vilket komplicerar riktad läkemedelsutveckling. Som den enda medlemmen av CX3C-kemokinreceptorunderfamiljen, uppvisar CX3CR1 unika fördelar som ett potentiellt läkemedelsmål vid behandling av åderförkalkning, cancer och neuropati. Men läkemedelsutvecklingen av CX3CR1 hämmas delvis av bristen på strukturell information som styr kemokinigenkänning och receptoraktivering.
I en studie publicerad i Science Advances den 29 juni gjorde ett forskarlag under ledning av Zhao Qiang och Wu Beili från Shanghai Institute of Materia Medica (SIMM) vid den kinesiska vetenskapsakademin, ett genombrott inom området för kemokinreceptorer genom att lösa kryoelektronmikroskopstrukturerna i CX3CR1 -Gi- och CX3CR1-CX3CL1-Gi-komplex.
Även om flera kemokinreceptorkomplexstrukturer i CC- och CXC-underfamiljerna har lösts, förblir den molekylära mekanismen för den unika igenkänningen av CX3CR1 och CX3CL1 okänd. Med analysen av strukturer och sekvensanpassning fann forskarna att de unika strukturella egenskaperna hos 30-talsslingan i CX3CL1 och ECL2-regionen i CX3CR1 spelar en nyckelroll i mekanismen för igenkänning av formkomplementaritet. Jämfört med CC- och CXC-kemokinerna resulterar det specifika CX3C-motivet för CX3CL1 i en större förskjutning av 30-talsslingan mot CX3CR1 ECL2.
Eftersom ECL2 i CX3CR1 innehåller färre rester än andra kemokinreceptorer, ger den kortare ECL2 i CX3CR1-CX3CL1 strukturen tillräckligt med utrymme för 30-talsslingan av CX3CL1. Emellertid uppvisar 30-talsslingan av andra kemokinunderfamiljer oförlängd konformation, som är komplementär till ytan av längre ECL2 av motsvarande receptorer.
Detta är första gången forskare har tillhandahållit den strukturella grunden för att klargöra den molekylära mekanismen för specifik igenkänning mellan CX3CR1 och dess unika endogena ligand.
Förutom specificiteten för kemotaktisk signaligenkänning, avslöjar ett annat viktigt fynd av denna studie att kolesterolmolekyler reglerar aktiveringen av CX3CR1. I de komplexa strukturerna av både CX3CL1-bundna och konstitutivt aktiverade tillstånd observerades tre kolesteroler stabilisera helix VI av CX3CR1 med en mycket mindre konformationsförändring än tidigare lösta klass A GPCR-Gi-komplexstrukturer. Med stöd av funktionella data för CX3CR1 och andra kemokinreceptorer, verifieras kolesterolerna ytterligare för att spela specifika viktiga roller i konformationsstabilisering och signaltransduktion av CX3CR1.
Denna studie ger insikter i den unika kemokinigenkänningsmekanismen för den mänskliga kemokinreceptorunderfamiljen. De distinkta kolesterolbindande platserna för CX3CR1 fördjupar vår kunskap om moduleringen av kolesteroler i GPCR. + Utforska vidare