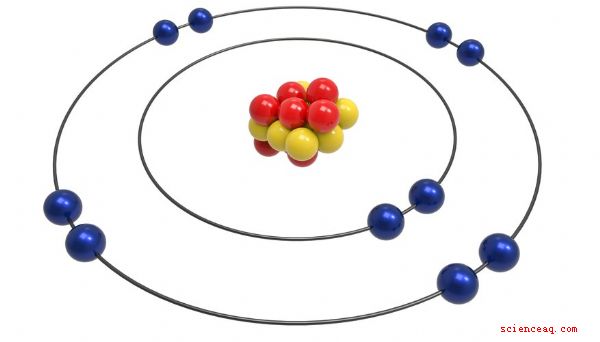
En atoms radie är avståndet från mitten av dess kärna till dess yttersta elektroner. Storleken på de olika elementens atomer - till exempel väte, aluminium och guld - förändras beroende på storleken på kärnan och hur mycket energi elektronerna har. Om du tittar på en periodisk tabell som visar atomradie kan du se hur ett elements placering i tabellen påverkar atomens storlek.
TL; DR (för lång; läste inte) |
antalet elektroner i en atom påverkar dess radie, liksom elektronernas energi.
Atomic Structure
En atom består av en central kärna av protoner och neutroner omgiven av ett moln av elektroner. Atomens storlek beror på en balansåtgärd som involverar några olika krafter. Protonen har en positiv elektrisk laddning, medan elektronen är negativ. De två typerna av partiklar lockar varandra - ju starkare attraktionen är, desto mindre är atomens radie. Men en atom med många elektroner tränger inte in dem i samma utrymme. De upptar flera koncentriska "skal", så ju fler elektroner, desto fler skal och desto större är atomen. En effekt som kallas "screening" komplicerar kraften som utövas av en stor kärna. De yttersta protonerna blockerar de inre, vilket minskar den totala attraktionen hos elektronerna. . Ju större atomantal, desto större är atomens radie. Detta gäller särskilt när du rör dig rakt ner i en given kolumn på det periodiska systemet. radien för varje på varandra följande angränsande atom ökar. Den växande storleken beror på det ökande antalet fyllda elektronskal när du rör dig ner i det periodiska systemet.
Periodisk tabellrad
I den periodiska tabellen tenderar elementets radie att minska när du rör dig över Antalet protoner ökar från vänster till höger, vilket leder till en större attraktiv kraft i kärnan. Den starkare attraktionen drar elektronerna närmare och minskar radien.
Elektronenergi
Elektriska strömmar och ljus båda bära energi. Om mängden energi är tillräckligt stor kan en atoms elektroner absorbera den. Detta får elektronerna att tillfälligt hoppa till ett skal längre bort från kärnan, vilket ökar atomens radie. Såvida inte elektron flyger helt bort från atomen, släpper den den energi som den just mottog och faller tillbaka till sitt ursprungliga skal. När detta händer krymper atomens radie till normal.