", 3, [[
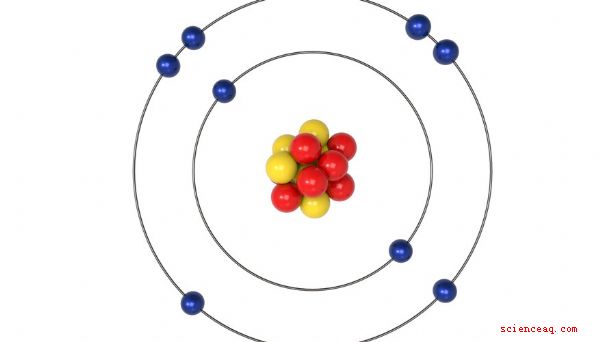
Valency är ett mått på reaktiviteten hos en atom eller molekyl. Du kan erhålla valentiteten hos många element genom att titta på deras positioner i det periodiska systemet, men det är inte sant för dem alla. Det är också möjligt att beräkna valensen hos en atom eller molekyl genom att notera hur den kombineras med andra atomer eller molekyler med kända valenser.
Octet Rule
Vid bestämning av en atom eller molekyls valens (en för som du inte kan använda den periodiska tabellen för att bestämma valens), kemister använder oktettregeln. Enligt denna regel kombineras atomer och kemikalier på ett sådant sätt att de producerar åtta elektroner i det yttre skalet av vilken förening det är. Ett yttre skal med åtta elektroner är fullt, vilket innebär att föreningen är stabil.
När en atom eller molekyl har från en till fyra elektroner i sitt yttre skal, har den en positiv valens, vilket betyder att den donerar sina fria elektroner . När antalet elektron är fyra, fem, sex eller sju, bestämmer du valensen genom att subtrahera elektronnumret från 8. Det beror på att det är lättare för atomen eller molekylen att acceptera elektroner för att uppnå stabilitet. Alla de ädla gaserna - utom helium - har åtta elektroner i sina yttersta skal och är kemiskt inerta. Helium är ett speciellt fall - det är inert, men det har bara två elektroner i sitt yttersta skal.
Periodic Table
Forskare har ordnat alla element som för närvarande är kända i ett diagram som kallas periodiska tabellen och i många fall kan du bestämma valens genom att titta på diagrammet. Till exempel har alla metaller i kolonn 1, inklusive väte och litium, en valens av +1, medan alla de i kolonn 17, inklusive fluor och klor, har en valens av -1. De ädla gaserna i kolumn 18 har en valens 0 och är inerta.
Du kan inte hitta valens för koppar, guld eller järn med den här metoden eftersom de har flera aktiva elektronskal. Detta gäller för alla övergångsmetaller i kolumnerna 3 till 10, de tyngre elementen i kolumnerna 11 till 14, lantaniderna (elementen 57-71) och aktiniderna (elementen 89-103).
Bestämmer Valency från kemiska formler
Du kan bestämma valensen hos ett övergångselement eller en radikal i en viss förening genom att notera hur det kombineras med element med känd valens. Denna strategi är baserad på oktetregeln, som säger att element och radikaler kombineras för att producera ett stabilt yttre skal av åtta elektroner.
Som enkla illustrationer av denna strategi, notera att natrium (Na), med en valens av +1, kombineras lätt med klor (Cl), som har en valens av -1, för att bilda natriumklorid (NaCl) eller bordsalt. Detta är ett exempel på en jonreaktion där en elektron doneras av en atom och accepteras av den andra. Det tar emellertid två natriumatomer att kombinera joniskt med svavel (S) för att bilda natriumsulfid (Na <2>), ett starkt alkaliserande salt som används i massabranschen. Eftersom det krävs två natriumatomer för att bilda denna förening måste svavelens valens vara -2.
För att tillämpa denna strategi på mer komplexa molekyler är det viktigt att först inse att element ibland kombineras för att bilda reaktiva radikaler har ännu inte uppnått ett stabilt yttre skal med åtta elektroner. Ett exempel är sulfatradikalen (SO <4>). Detta är en tetraedrisk molekyl där svavelatomen delar elektroner med fyra syreatomer i det som kallas en kovalent bindning. I en sådan förening kan du inte härleda atomerna i radikalen genom att titta på formeln. Du kan dock bestämma valens hos radikalen med jonföreningarna som den bildar. Till exempel kombineras sulfatradikalen joniskt med väte för att bilda svavelsyra (H <2SO 4). Denna molekyl innehåller två väteatomer, var och en med en känd valens +1, så i detta fall är valens av radikalen -2. När du har bestämt valens hos radikalen kan du använda den att beräkna valensen hos andra element och molekyler som den kombineras med. Till exempel är järn (Fe) en övergångsmetall som kan uppvisa flera valenser. När den kombineras med sulfatradikalen för att bilda järnsulfat, FeSO 4, måste dess valens vara +2, eftersom sulfatradikalens valens, bestämd utifrån bindningen den bildar med väte, är -2.