Covid-19-pandemin resulterade i miljontals dödsfall. Trots ett oöverträffat forskningssamarbete som ledde till att effektiva vacciner och terapier producerades på rekordtid, saknas fortfarande en fullständig förståelse för strukturen och livscykeln för coronaviruset, känt som SARS-CoV-2.
Forskare använde biolabben och SPB/SFX-instrumentet vid Europeiska XFEL för att studera virusets huvudsakliga proteas, eller Mpro, för att förstå hur det skyddar sig mot oxidativ skada. Resultaten tillför nyckelkunskaper till vår förståelse av hur SARS-CoV-2 fungerar och området för viral biologi.
Artikeln är publicerad i tidskriften Nature Communications .
Mellan januari 2020 och mars 2023 dog över sex miljoner människor till följd av luftvägssjukdomen COVID-19, och flera hundra miljoner smittades. Sjukdomen orsakas av SARS-CoV-2, ett coronavirus.
"Coronavirus är en grupp RNA-virus som orsakar sjukdomar och sjukdomar hos däggdjur och fåglar", förklarar den europeiska XFEL-forskaren Richard Bean. "Men trots deras betydande relevans för den globala mänskliga hälsan, finns det fortfarande mycket att lära om strukturen och funktionen hos koronavirus i allmänhet och SARS-CoV-2 i synnerhet."
Som svar på utbrottet av pandemin, satsade forskare och vetenskapliga organisationer runt om i världen på att studera strukturen, dynamiken och funktionen hos SARS-CoV-2 i jakt på vacciner och terapier. På grund av sin centrala roll i virusets replikationscykel, dök det huvudsakliga proteaset – ett enzym som frigör nytillverkade bitar av viruset från varandra – snart fram som ett viktigt antiviralt läkemedelsmål.
Huvudproteaset, eller Mpro, är särskilt attraktivt för läkemedelsutveckling eftersom det spelar en central roll i viral replikation, och även för att det skiljer sig ganska mycket från alla mänskliga proteiner. Detta gör det möjligt för behandlingar att specifikt inrikta sig på viruset samtidigt som biverkningar som kan skada patienter minimeras. Tidigare läkemedelsupptäcktsprogram riktade mot andra virus har lyckats använda virala proteashämmare, vilket gör ett framgångsrikt resultat i fallet med SARS-CoV-2 mer sannolikt.
"Även om höjden av covid-19-pandemin kan ha passerat, finns det fortfarande mycket värde i att studera SARS-CoV-2-viruset", säger Thomas Lane från Center for Free-Electron Laser Science (CFEL) i Hamburg. "COVID fortsätter att utgöra ett betydande hälsohot över hela världen. Med tanke på det här virusets ihållande och den möjliga uppkomsten av framtida patogena coronavirus är det absolut nödvändigt att vi utvecklar en djupare förståelse för Mpro och dess roll i viral funktion."
I ett nyligen experiment vid SPB/SFX-instrumentet vid Europeiska XFEL, använde Lane och kollegor den intensiva röntgenstrålen för att studera Mpro. Flera tidigare strukturstudier med fokus på Mpro har belyst ett antal egenheter.
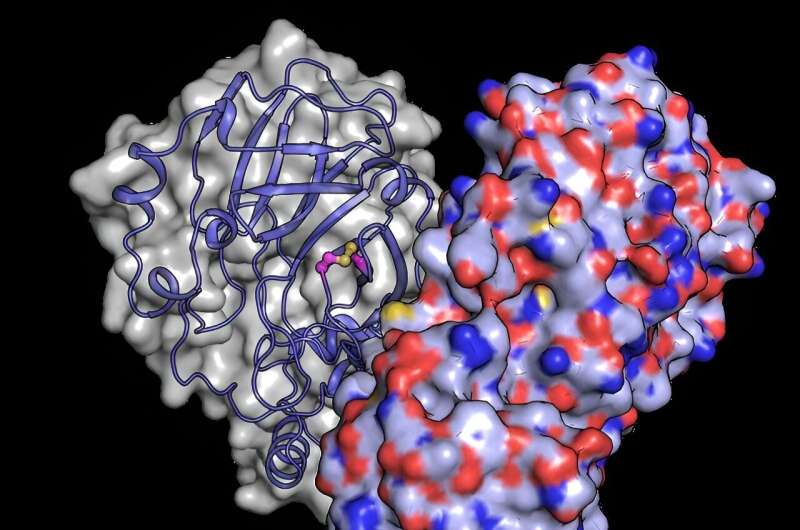
"För det första bildar proteinet en 3D-struktur som kallas en dimer när det finns i höga koncentrationer", förklarar den europeiska XFEL-forskaren Robin Schubert, som var involverad i experimentet. "Denna strukturella vana verkar direkt påverka dess aktivitet - men vi vet inte exakt varför detta är viktigt för viruset." Vid sidan av viktiga insikter om 3D-strukturen har nyligen genomförda studier också antytt betydelsen av cellulära syrenivåer för proteasaktivitet.
"Det verkar som att även mild exponering för syre minskar Mpros aktivitet", förklarar Patrick Reinke, även han från CFEL. Faktum är att i närvaro av tillräckligt med syre upphör omsättningen helt och hållet. Men denna process är reversibel – om syret avlägsnas, reaktiverar enzymet sig självt, vilket tyder på att systemet har utvecklat skyddsmekanismer för att överleva i en oxidativ miljö.
"Oxidativ stress har visat sig reglera funktionen hos andra virus, såsom HIV," tillägger Reinke. "Det har föreslagits att strukturella förändringar i proteaset låter det undkomma oxidativ skada i syrerika miljöer. Men vi är fortfarande osäkra på hur dessa skyddsmekanismer påverkar viral kondition."
För att bättre förstå hur strukturella förändringar skyddar proteinet från syreskador, använde teamet den europeiska XFEL:s kraftfulla röntgenstråle för att avslöja strukturen hos Mpro efter att den hade exponerats för syre. De upptäckte en strukturell omarrangemang av Mpro där en bindning bildas mellan två cysteinrester:det aktiva stället cystein C145 och ett distalt cystein C117.
För att åstadkomma detta producerade teamet stora mängder Mpro under flera månader i biolabbet på European XFEL och förvandlade det till mikrokristaller, av vilka några odlades i närvaro av syre. Slutligen skickades mikrokristallerna flygande framför den europeiska XFEL-strålen vid SPB/SFX-instrumentet med hjälp av en vätskestråle.
Sådana små kristaller är omöjliga att studera med traditionella ljuskällor eftersom mängden strålning som behövs för att generera tillräckligt med data från kristallerna skulle förstöra dem. Röntgenpulserna som produceras av den europeiska XFEL är dock så kraftfulla och korta att de kan användas för att fånga en bild av proteinkristallen innan den hinner sönderfalla.
"Våra resultat visar att det aktiva stället cystein, som leder enzymets kemi, kan smygt gömma sig från oxidativ skada", säger Schubert. Typiskt kan oxidation irreversibelt skada cysteiner.
Vid oxidation skyddar Mpro dock dess viktigaste cystein genom att bilda vad som kallas en "disulfidbindning", som begraver det i kärnan av proteinstrukturen. Sedan, om den flyttas tillbaka till en säker miljö med låg syrehalt, kan disulfidbindningen bryta och avslöja det aktiva cysteinet, som återupptar sin ursprungliga funktion.
"Experimenten som utfördes på European XFEL avslöjar en bild av proteinet i dess dolda disulfidtillstånd, vilket bekräftar att det existerar och avslöjar hur det fungerar", säger Schubert.
"Mpro uppvisar en ovanligt rik uppsättning oxidationsmodifieringar, och vårt experiment lägger till en nyckelbit till den historien", säger Lane. Forskarna är spända på vad deras data indikerar och om deras nästa steg. "Mpro är en grundbult i coronavirusbiologin och det främsta målet för anti-COVID-19 småmolekylära terapier.
"Enzymets funktion har visat sig regleras via både dimerisering och oxidation, och det är tydligt att dessa regleringsmekanismer är biofysiskt korrelerade. Medan våra strukturer ger mekanistisk insikt i dessa egenskaper hos Mpro måste vi nu förstå hur reglering baserad på oxidativ stress eller proteinkoncentration påverkar viral fitness Detta kommer att ge djupare insikter i viral biologi och förhoppningsvis öppna nya möjligheter att störa den biologin med livsbevarande läkemedel."
Mer information: Patrick Y. A. Reinke et al, SARS-CoV-2 Mpro svarar på oxidation genom att bilda disulfid- och NOS/SONOS-bindningar, Nature Communications (2024). DOI:10.1038/s41467-024-48109-3
Journalinformation: Nature Communications
Tillhandahålls av Europeiska XFEL