Den som vill tillverka medicin, plast eller gödsel med konventionella metoder behöver värme för kemiska reaktioner – men inte så med fotokemi, där ljus ger energin. Processen för att uppnå den önskade produkten tar också ofta färre mellansteg.
Forskare från universitetet i Basel går nu ett steg längre och visar hur energieffektiviteten för fotokemiska reaktioner kan höjas 10 gånger. Mer hållbara och kostnadseffektiva applikationer är nu lockande nära.
Industriella kemiska reaktioner sker vanligtvis i flera steg över olika mellanprodukter. Fotokemi möjliggör genvägar, vilket innebär att färre mellansteg krävs. Fotokemi låter dig också arbeta med mindre farliga ämnen än i konventionell kemi, eftersom ljus ger en reaktion i ämnen som inte reagerar bra under värme. Men hittills har det inte funnits många industriella tillämpningar för fotokemi, delvis för att energiförsörjning med ljus ofta är ineffektivt eller skapar oönskade biprodukter.
Forskargruppen ledd av professor Oliver Wenger vid universitetet i Basel beskriver nu en grundläggande princip som har en oväntat stark inverkan på fotokemins energieffektivitet och kan öka hastigheten på fotokemiska reaktioner. Deras resultat publiceras i Nature Chemistry .
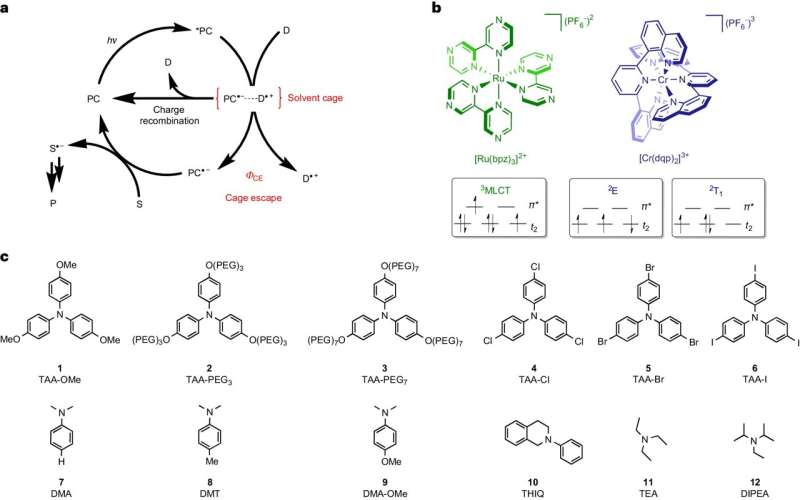
Vid denna typ av reaktion är startmolekylerna i en flytande lösning. Om de får energi i form av ljus kan de utbyta elektroner med varandra och bilda radikaler. Dessa extremt reaktiva molekyler förekommer alltid i par och förblir omgivna av lösningsmedel, som omsluter paren av radikaler som en sorts bur.
För att radikalerna ska kunna fortsätta att reagera på de önskade målprodukterna behöver de "bryta sig ut" ur denna bur och hitta en reaktionspartner utanför den. Teamet kring Wenger och hans postdoc Dr Cui Wang identifierade denna process att bryta ut som ett avgörande steg som begränsar energieffektiviteten och hastigheten för fotokemiska reaktioner.
Så länge som radikalerna förblir i par i lösningsmedelsburen, kan de spontant reagera med varandra tillbaka till utgångsmaterialen. Denna omvända reaktion slösar energi eftersom den bara använder det ljus som redan absorberats för att komma tillbaka till startpunkten.
Basel-teamet kunde bromsa denna omvända reaktion och därför ge radikalerna mer tid att lämna buren. Ju längre den oönskade omvända reaktionen blev, desto fler radikaler kunde bryta ut och desto mer energieffektiva och snabbare utvecklades de önskade målprodukterna.
Wang, som nu innehar positionen som biträdande professor vid universitetet i Osnabrück, använde två speciella färgämnen i sin studie, som båda absorberar ljus och lagrar dess energi under en kort period innan de används för att bilda par av radikaler. Det ena av de två undersökta färgämnena kunde dock lagra betydligt mer energi än det andra och överföra den till radikalerna.
På grund av den extra energin kunde radikalerna lämna lösningsmedelsburen upp till tio gånger mer effektivt. Följaktligen produceras målprodukterna med upp till tio gånger högre energieffektivitet. "Denna direkta koppling mellan radikalerna som bryter ut ur lösningsmedelsburen och den effektiva bildningen av målprodukterna är häpnadsväckande tydlig", sa Wang.
Nyckelfynden är att vissa färgämnen kan frigöra fler radikaler än andra per mängden ljus som absorberas. "Valet av färgämne kan användas för att öka energieffektiviteten för fotokemiska reaktioner", säger Wenger. I sin tur konstaterar han att energieffektivitet också är ett avgörande kriterium för industriell användning av fotokemi.
Mer information: Burescape styr fotoredox-reaktionshastigheter och kvantutbyten, Naturkemi (2024). DOI:10.1038/s41557-024-01482-4
Tillhandahålls av University of Basel