Peptider är korta strängar av aminosyror som används alltmer terapeutiskt, som biomaterial och som kemiska och biologiska sonder. Förmågan att isolera, manipulera och märka peptider och större proteiner är dock begränsad av förmågan att på ett tillförlitligt sätt fästa funktionella molekyler, såsom fluorescerande föreningar, till peptider på platser som inte kommer att påverka den tredimensionella strukturen och funktionen hos den korta. aminosyrasträng.
Forskare är mest intresserade av att lägga till funktionella molekyler till N-terminalen, eller änden av en peptid med en fri amingrupp (NH2 ), av en aminosyrasträng för att minimera interferensen av funktionella molekyler med strukturen och funktionen av den bundna peptiden.
Tidigare metoder för att fästa funktionella molekyler till N-terminalen av peptider var otillräckliga av flera skäl:(1) de funktionella grupperna skulle frigöras från peptiden under mänskliga fysiologiska tillstånd, (2) endast en funktionell grupp kunde fästas till en peptid vid en tid, (3) bindning av funktionella molekyler till peptider var inte enhetlig, eller (4) reaktioner var helt enkelt inte effektiva.
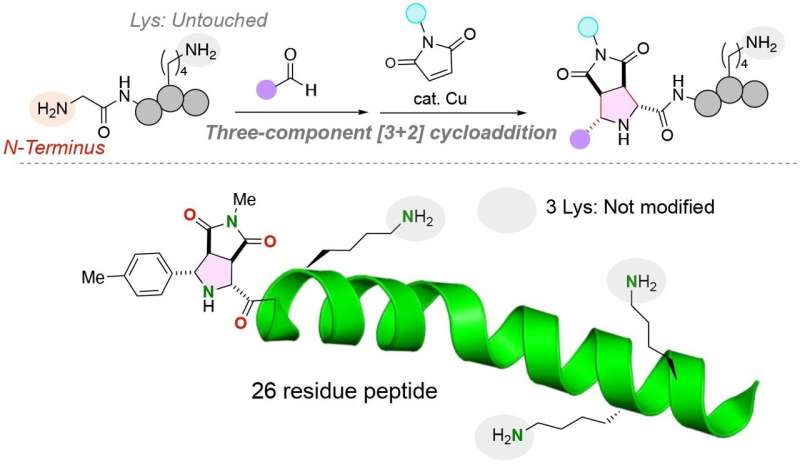
För att lösa detta problem utvecklade forskare från Tohoku University och Chuo University en unik kemisk reaktion för att fästa två distinkta funktionella molekyler till N-terminalen av en peptid med en glycinaminosyra vid N-terminalen. Forskarna publicerade sin studie i numret 28 januari 2024 av tidskriften Angewandte Chemie International Edition .
"Utmaningen [att modifiera peptidstrukturer] ligger i att uppnå platsselektiv modifiering, särskilt i närvaro av mycket reaktiva lysinrester. Vårt tillvägagångssätt är anmärkningsvärt för dess förmåga att uteslutande funktionalisera N-terminalen av peptider, oberoende av lysinrester, vilket resulterar i i strukturellt enhetliga konjugat i höga utbyten.
"Dessutom underlättar trekomponentsprotokollet den samtidiga installationen av två funktionella molekyler i en peptid", säger Kazuya Kanemoto, senior författare till uppsatsen och biträdande professor vid Graduate School of Pharmaceutical Sciences vid Tohoku University i Japan.
Teamet fäste framgångsrikt de två distinkta funktionella molekylerna till glycinaminosyran genom att använda en kopparkatalysator i en trekomponentreaktion av peptider, aldehyder (vilken organisk förening som helst med en kolatom som delar en dubbelbindning med en syreatom, en enkelbindning med en väteatom och en enkelbindning med en annan atom) och maleimider, molekyler som är viktiga byggstenar i organiska syntesreaktioner.
Anmärkningsvärt nog utförs reaktionen i en enda behållare under milda förhållanden, vilket resulterar i en mycket effektiv reaktion med stabila kol-kolbindningar mellan peptidens N-terminal och de funktionella molekylerna.
Lysinaminosyror, i synnerhet, har komplicerat tillägget av funktionella molekyler till N-terminalen av peptider. Den funktionella gruppen av lysinaminosyror är en amingrupp som potentiellt skulle kunna konkurrera med amingruppen som finns i N-terminalen av en peptidsträng. Viktigt är att den kemiska reaktion som utvecklats av forskargruppen endast märker den N-terminala anime-gruppen av peptider även om en lysinaminosyra, som innehåller en alternativ amingrupp, finns i peptiden.
Forskargruppen fann att den N-terminala bindningen av funktionella grupper till peptider kunde optimeras för en mängd olika di-, tri- och oligopeptider, vilket visar reaktionens potentiella användbarhet vid märkning av olika peptider och potentiellt större proteiner för rening, detektion och andra ändamål .
Forskarna testar redan funktionen hos peptider som har modifierats genom sin nya reaktion för att fastställa slutproduktens lämplighet för olika forsknings- och terapeutiska ändamål.
"Våra efterföljande steg involverar att utvärdera den biologiska aktiviteten hos peptider som framställts av denna reaktion. Dessutom strävar vi efter att utöka tillämpningen av detta platsselektiva dubbelmodifieringsprotokoll till större peptider som proteiner och antikroppar, vilket visar löfte om framsteg inom läkemedelstillförsel." sa Kanemoto.
Mer information: Haruka Machida et al, N-Terminal-Specific Dual Modification of Peptides through Copper-Catalyzed [3+2] Cycloaddition, Angewandte Chemie International Edition (2024). DOI:10.1002/anie.202320012
Tillhandahålls av Tohoku University