Lassavirus (LASV) är den patogen som orsakar Lassa hemorragisk feber, en sjukdom som är endemisk i Västafrika, som orsakar cirka 5 000 dödsfall varje år. Vid CSSB Center for Structural Systems Biology arbetade grupperna Uetrecht (CSSB, LIV, Uni Siegen), Kosinski (CSSB, EMBL) och Rosenthal (BNITM, CSSB) tillsammans för att avslöja den avgörande roll som RNA spelar i kritiska steg i Lassa virusets livscykel.
Deras resultat publiceras i Journal of the American Chemical Society .
I människokroppen producerar 20 000 gener över en miljon olika former av proteiner. Lassa-viruset i jämförelse är minimalt eftersom det endast består av fyra proteiner, kända som L, NP, Z och GPC.
"Vi försöker förstå hur dessa fyra proteiner kan orsaka så allvarlig skada på mänskliga celler", förklarar tidningens första författare Lennart Sänger. "Aktiviteten och uttrycket av dessa proteiner måste regleras hårt och proteinerna måste kommunicera effektivt med varandra för att kunna ta på sig olika funktioner."
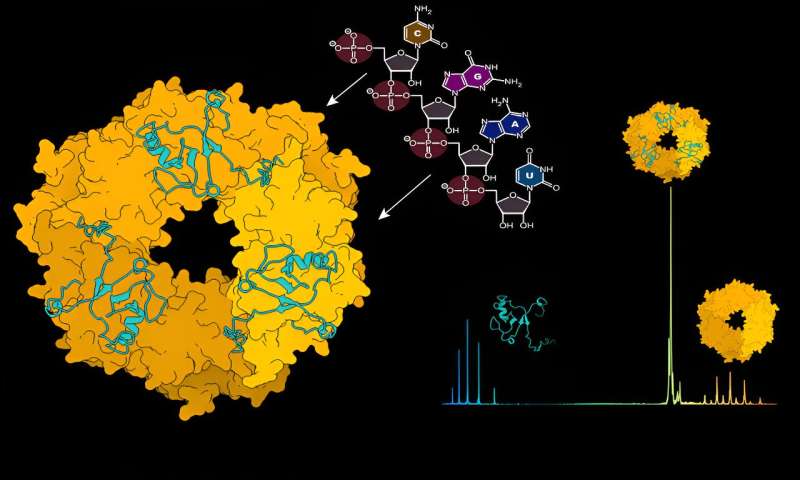
För att skydda och dölja viruset från detektion av immunsystemet, omsluter nukleoproteinet (NP) det virala genomet i en kapsid. Denna kapsid bildar tillsammans med viralt RNA och L-proteinet ribonukleoproteinkomplex (RNP).
För att sprida infektion måste RNP:er kontinuerligt omstrukturera sig själva för att möjliggöra viral genomreplikation och transkription. Forskarna undersökte interaktionerna mellan NP och viralt RNA samt Z-proteinet för att få en bättre förståelse av mekanismen och dynamiken i RNP-bildning och förpackning till nya virala partiklar.
Med hjälp av strukturell masspektrometri, en metod som fungerar som en molekylär skala genom att avslöja atomvikten av molekylära interaktioner, undersökte forskarna dynamiken mellan NP och viralt RNA. "Initialt existerar inte NP-proteinet i en sammansättning som kan binda viralt RNA", förklarar Charlotte Uetrecht, en CSSB-gruppledare och expert på masspektrometritekniker.
"En förändring måste ske för att möjliggöra denna bindning och vi upptäckte att viralt RNA kan initiera denna förändring av sig själv." Forskarna identifierade RNA som drivkraften för demonteringen av ringliknande NP-trimerer till monomerer som sedan kan bilda högre ordnings RNA-bundna NP-sammansättningar.
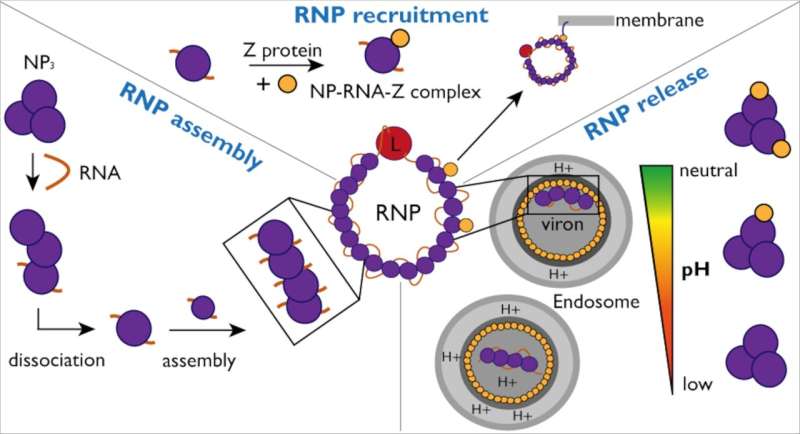
Forskarna undersökte också NP-interaktion med Z-proteinet mer i detalj. För att underlätta detta använde Kosinski-gruppen AlphaFold för att förutsäga NP-Z-komplexets interaktionsplats. Dessa förutsägelser verifierades sedan av forskare i laboratoriet.
"Att använda artificiell intelligens gjorde det möjligt för oss att snabbt identifiera möjliga interaktioner och gjorde det också möjligt för oss att skapa mutanter för att verifiera vår hypotes", konstaterar Jan Kosinski. Forskarna kunde till slut visa att medan NP binder Z oberoende av närvaron av RNA, är denna interaktion pH-beroende.
"Sammantaget hjälper dessa fynd att förbättra vår förståelse av RNP-montering, rekrytering och frisättning i Lassa-virus", förklarar Maria Rosenthal, en Lassa-virusexpert vid Bernhard Nocht Institute for Tropical Medicine och en CSSB-associerad medlem. I Västafrika förutspås 186 miljoner människor vara i riskzonen för Lassa-virusinfektion år 2030, och Världshälsoorganisationen erkänner Lassa-viruset som en farlig och ändå understuderad patogen.
"Att förstå hur Lassa-virus fungerar kan i slutändan göra det möjligt för oss att utveckla molekyler som kan hämma replikationen av detta virus och behandla Lassa-feber", konstaterar Rosenthal.
Mer information: Lennart Sänger et al, RNA to Rule Them All:Critical Steps in Lassa Virus Ribonucleopartikel Assembly and Recruitment, Journal of the American Chemical Society (2023). DOI:10.1021/jacs.3c07325
Journalinformation: Tidskrift för American Chemical Society
Tillhandahålls av CSSB Center for Structural Systems Biology