Kemisk diversifiering av proteiner är ett viktigt begrepp i studiet av biologiska processer och de komplexa strukturerna hos själva proteinerna. Forskare från Max Planck Society har nu publicerat sina fascinerande rön om en aminosyra i Nature Chemistry .
Kemisk diversifiering av proteiner innebär att man använder snabba och milda reaktioner som selektivt riktar sig mot en specifik aminosyra och därför en byggsten av proteiner. Cystein är ett framträdande exempel och kan för närvarande modifieras på två sätt. Det första sättet kräver syntes av elektrofiler för varje önskad modifiering, t.ex. en fluorescensprob som gör det möjligt att följa molekylen i mycket komplexa biologiska blandningar.
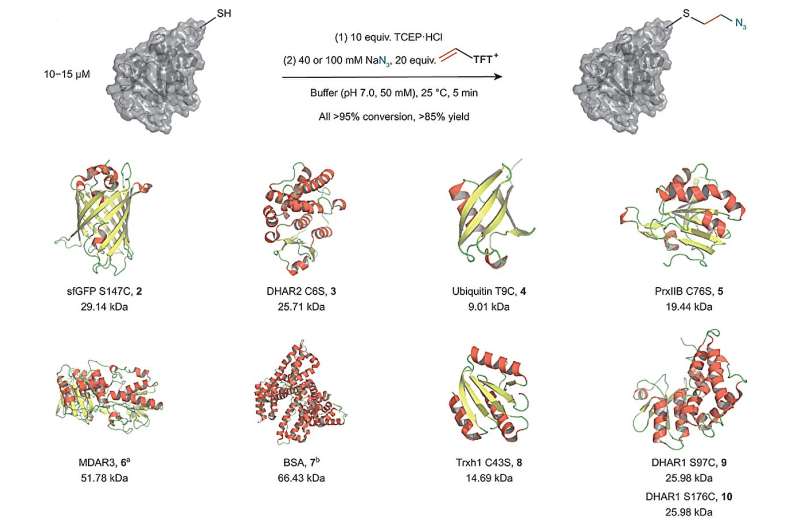
Det andra sättet förvandlar cystein i sig till en kemisk nyckel, som sedan kan diversifieras. Fram till nu har detta utförts i flerstegssynteser. Dessa metoder har nackdelen att stiftet inte kan införas i närvaro av externa reagens som krävs för dess diversifiering. Det åtföljs ofta av ett begränsat urval av reagenser för funktionaliseringen eftersom stiftet måste kvarstå i lösning under reningsprocesser och därför har en i sig minskad reaktivitet.
En ny teknik av Tobias Ritters forskargrupp, chef vid Max-Planck-Institut für Kohlenforschung, är spännande eftersom den möjliggör införandet av en mycket reaktiv mellanprodukt i en enkärlsprocess baserad på en enda elektrofil. Dessutom möjliggör denna metod en bred diversifiering av den nya mellanprodukten även i närvaro av externa reagens.
I sin studie hittade Ritter-gruppen ett sätt att använda vinyltiantreniumsalter för att omvandla cystein till en mycket reaktiv episulfoniumelektrofil in situ. Det tillvägagångssättet gör det möjligt att koppla cystein med olika andra externa nukleofiler i en enda enkärlsprocess utan behov av ytterligare steg. Metoden gör det möjligt för forskarna att koppla olika biorelevanta funktionella grupper till proteiner med hjälp av en kort och stabil etenbindning mycket nära proteinets yta. Det ger därför ett nytt och attraktivt sätt att lägga till etiketter eller funktioner som förändrar den kemiska miljön för ett protein.
När inga externa nukleofiler tillsätts kan andra aminosyror reagera med episulfoniummellanprodukten i en intramolekylär reaktion. Den reaktiviteten möjliggör protein-proteinligering och makrocyklisering av linjära peptider. Medan det första tillvägagångssättet gör det möjligt att studera proteinkomplex och deras ofta förändrade biologiska aktivitet, gör det andra tillvägagångssättet peptiderna mer stabila mot biologisk nedbrytning om de används, till exempel som ett läkemedel.
Dessutom tillät syntesen av vinyltiantreniumsalter från etengas Ritter-gruppen att syntetisera reagens med en annan sammansättning av isotoper. Dessa isotopmärkta föreningar har samma reaktivitet som de omärkta derivaten men skiljer sig något i sin molekylvikt. Därför kan de användas i toppmodern masspektrometri-proteomikforskning för att extrahera kvantitativ information från hela cellulära system. Sammantaget visas metoden med vinyltiantreniumsalter som ett användbart och brett tillämpbart verktyg inom kemisk biologi.
Mer information: Philipp Hartmann et al, Kemoselektiv ompolering av tioler till episulfonium för cysteinbiokonjugation, Nature Chemistry (2023). DOI:10.1038/s41557-023-01388-7
Journalinformation: Naturkemi
Tillhandahålls av Max Planck Society