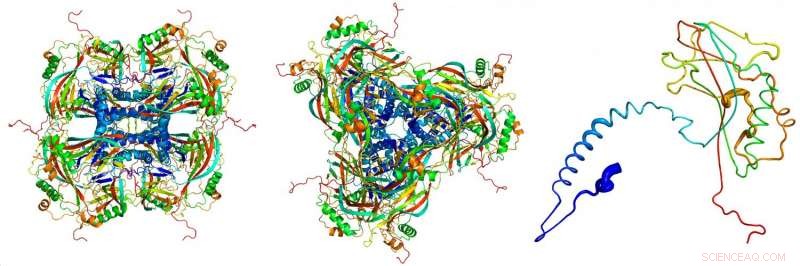
Atommodell av de kristallina ocklusionskropparna, härrör från röntgendiffraktionsbilder som spelats in på röntgenfri elektronlaser LCLS vid SLAC National Accelerator Laboratory. De enskilda proteinerna (höger) håller ihop för att bilda byggstenarna (vänster, sett från sidan; Centrum, sett uppifrån) av de kristallina ocklusionskropparna. Upphovsman:Dominik Oberthuer, CFEL/DESY
Ett internationellt team av forskare har använt högintensiva röntgenpulser för att bestämma strukturen på det kristallina proteinhöljet hos ett insektsvirus. Deras analys avslöjar de fina detaljerna i byggstenarna som utgör den virala kokongen ner till en skala på 0,2 nanometer (miljondelar av en millimeter) - närmar sig upplösning i atomskala. De små virusen med sitt kristallhölje är överlägset de minsta proteinkristaller som någonsin analyserats med hjälp av röntgenkristallografi. Detta öppnar nya möjligheter i studien av proteinstrukturer, som teamet som leds av DESY:s ledande forskare Henry Chapman från Center for Free-Electron Laser Science rapporterar i Förfaranden från National Academy of Sciences ( PNAS ).
"Granuloviruset angriper vissa insekter och dödar dem. Detta lämnar det initialt strandat inuti den förfallna värden, så det måste skydda sig själv, kanske i flera år, mot ogynnsamma miljöförhållanden som värme, ultraviolett strålning och torka, tills den åter intas av en insekt. För att uppnå detta, viruset omsluter sig i en kokong gjord av proteinkristaller, som bara löses upp igen när den når insektens tarm, "förklarar Cornelius Gati från DESY, huvudförfattaren till tidningen. Dessa virus är ett särskilt intresse för Peter Metcalf från University of Auckland i Nya Zeeland och Johannes Jehle från Julius Kühn Institute i Darmstadt, som samarbetade med DESY för denna forskning. Forskarna undersökte kokongen av Cydia pomonella granulovirus (CpGV), som infekterar larverna från codling moth ( Cydia pomonella ) och används inom jordbruket som ett biologiskt bekämpningsmedel. Viruset är ofarligt för människor.
Forskare är intresserade av den rumsliga strukturen hos proteiner och andra biomolekyler eftersom detta belyser det exakta sättet på vilket de fungerar. Detta har lett till en specialiserad vetenskap som kallas strukturbiologi. "Under de senaste 50 åren har forskare har bestämt strukturerna för mer än 100, 000 proteiner, "säger Chapman, som också är professor i fysik vid universitetet i Hamburg. "Det absolut viktigaste verktyget för detta är röntgenkristallografi." I denna metod, en kristall av proteinet som undersöks odlas och bestrålas med ljusa röntgenstrålar. Detta ger ett karakteristiskt diffraktionsmönster, varifrån kristallens rumsliga struktur och dess byggstenar kan beräknas.
"En av de stora utmaningarna med detta förfarande är, dock, växer kristallerna, "tillägger Chapman. Många proteiner anpassar sig inte direkt till kristaller, för det är inte deras naturliga tillstånd. Ju mindre kristaller som kan användas för analysen, desto lättare är det att odla dem, men desto svårare är det att mäta dem. "Vi hoppas att vi i framtiden helt kan avstå från växande kristaller och studera enskilda molekyler direkt med hjälp av röntgenstrålar, "säger Chapman, "så vi skulle vilja förstå gränserna".
"Dessa viruspartiklar gav oss de minsta proteinkristaller som någonsin använts för röntgenstrukturanalys, "förklarar Gati. Ocklusionskroppen (viruset" kokong ") har en volym på cirka 0,01 kubikmikrometer, ungefär hundra gånger mindre än de minsta artificiellt odlade proteinkristallerna som hittills har analyserats med användning av kristallografiska tekniker.
För att bryta denna gräns i kristallstorlek, en extremt ljus röntgenstråle behövdes, som erhölls med en så kallad frielektronlaser (FEL), i vilken en stråle av höghastighetselektroner styrs genom en magnetisk böljare som får dem att avge laserliknande röntgenpulser.
Forskarna använde frielektronlasern LCLS vid SLAC National Accelerator Laboratory i USA, och använde optik för att fokusera varje röntgenpuls till en liknande storlek som en av viruspartiklarna. "Att rikta hela kraften i FEL på ett litet virus utsatte det för de enorma strålningsnivåerna, "rapporterar Gati, som nu arbetar på SLAC. Dosen var 1,3 miljarder Grays; för jämförelse:den dödliga dosen för människor är cirka 50 gråtoner.
FEL -dosen var säkerligen också dödlig för virusen - var och en förångades helt av en enda röntgenpuls. Men femtosekund-varaktighetspulsen bär informationen om den orörda strukturen till detektorn och förstörelsen av viruset inträffar först efter att pulsen har passerat. Analysen av den inspelade diffraktionen visade att även små proteinkristaller som bombarderas med extremt höga strålningsdoser fortfarande kan avslöja sin struktur i atomskala.
"Simuleringar baserade på våra mätningar tyder på att vår metod förmodligen kan användas för att bestämma strukturen för ännu mindre kristaller som består av bara hundratals eller tusentals molekyler, "rapporterar Chapman, som också är medlem i Hamburg Center for Ultrafast Imaging (CUI). "Detta tar oss ett stort steg längre mot vårt mål att analysera enskilda molekyler."