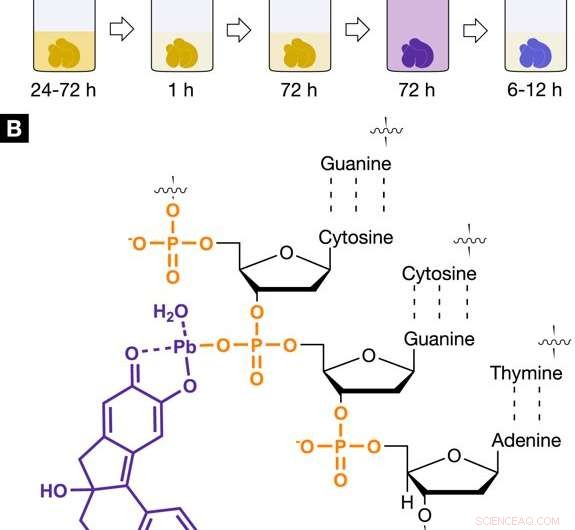
Röntgen lämplig, kärnspecifika färgämnesprotokoll för virtuell 3D-histologi. Färgningsprotokoll och interaktion av hematinbaserad röntgenfärg med mjuk vävnad. (A) Den utvecklade hematinbaserade färgningsförfarandet visar de enskilda stegen som ingår inklusive inkubation och färgningstider. Färgningssteg 1 utfördes med användning av bly (II) acetattrihydrat som tungmetallkälla. Bly (II) acetattrihydrat löstes i destillerat vatten och kallas arbetslösning (A) (WS (A)). Färgningssteget 2 involverade en hemateinlösning i absolut etanol (WS (B), 10% (vikt/volym); c =333 mM), som härleddes från hematoxylin och sattes till WS (A). (B) Det positivt laddade hematein -bly (II) -komplexet (lila), som är byggt in situ i mjukvävnadsprovet, interagerar med den negativt laddade fosfatstommen i DNA (apelsin) som finns i cellens kärna. Den selektiva interaktionen mellan hematein -bly (II) -komplexet och DNA uppnås genom försurning av mjukvävnaden under fixering eller före färgning och möjliggör en högre ackumulering av hematein -bly (II) -komplexet i cellkärnan. Kreditera: Vetenskapliga rapporter , doi:https://doi.org/10.1038/s41598-018-36067-y
Histologi används för att identifiera strukturella detaljer om vävnad i mikroskala i patologilaboratoriet, men analyser förblir tvådimensionella (2D) eftersom de är begränsade till samma plan. Icke-destruktiv 3D-teknik inklusive röntgenmikro och nano-datortomografi (nanoCT) har bevisat sin giltighet för att förstå anatomiska strukturer, eftersom de tillåter godtyckliga betraktningsvinklar och 3D -strukturella detaljer. Dock, låg dämpning av mjukvävnad har försvårat deras tillämpning inom 3D virtuell histologi. I en färsk studie, nu publicerad den Vetenskapliga rapporter , Mark Müller och kollegor vid Institutionen för fysik och bioingenjör har utvecklat en hematinbaserad röntgenfärgningsmetod för att specifikt rikta in sig på cellkärnor, följt av demonstrationer på en hel leverlob hos en mus.
Det nya färgningsprotokollet kombinerade det nyligen utvecklade, högupplöst nanoCT -system för 3D -visualisering av vävnadsarkitekturen i nanometerskala. Resultaten avslöjade den verkliga 3D -morfologin vid sidan av rumslig fördelning av cellkärnor. Tekniken var också kompatibel med konventionell histologi, som mikroskopiska objektglas med mjukvävnadsprov kan färgas med samma protokoll tillsammans med ytterligare motfärgning. Metoden visade möjligheten för framtida tillämpningar inom histopatologi tillsammans med röntgen CT-enheter i labbet.
Histologi är den befintliga guldstandarden för en exakt mikroanatomisk diagnos i patologilaboratoriet, tekniker och resultat är dock begränsade till 2D. Till exempel, en 3D-biopsi undersöks vanligtvis med mycket tunna mikroskopiska objektglas (innehållande 2-10 µm tjocka skivor) via konventionella och moderna immunhistokemiska och histologiska färgningstekniker. Mikro- och nano-CT är kraftfulla verktyg som kan ge en exakt rekonstruktion av vävnad i 3D. Teknikens utveckling har möjliggjort jämförelsevis hög upplösning till befintlig 2D konventionell histologi, med hjälp av enheter som sträcker sig från stora partikelacceleratorer till laboratoriebaserade röntgenapparater.
Förutom de tekniska kraven, Röntgen lämpliga färgämnen (kontrastmedel) såsom fototungstinsyra (PTA), jodkaliumjodid (IKI), jod i etanol (12E), eller jod i metanol (12M) är också viktiga. De tillgängliga färgämnena är dock för närvarande begränsad i omfattning och effekt. Vid utveckling av nästa generations medicinsk diagnostik inom histopatologi, forskare syftar till att optimera teknikerna och förstå vävnadsarkitektur från cellnivå till vävnadsskala.
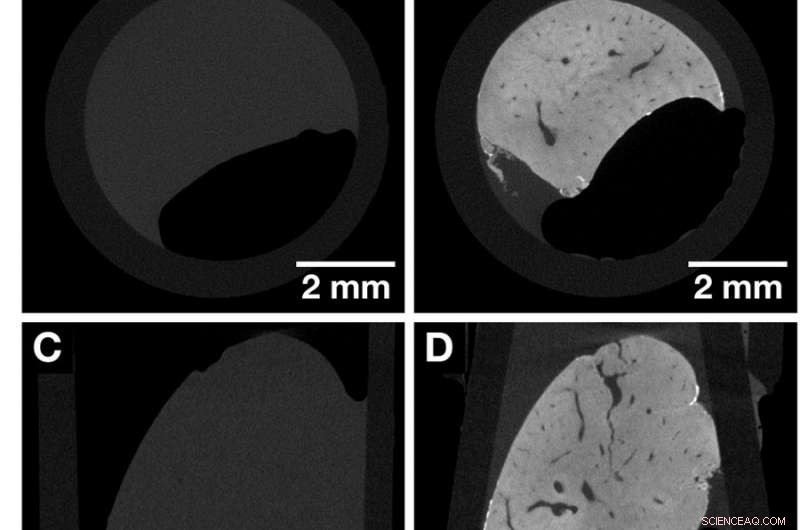
CT-skivor av samma hela musleverlobobuli före och efter färgning markerar kontrastförbättringen som erhålls efter applicering av den hematinbaserade röntgenfärgen. Båda datamängderna förvärvades med Xradia Versa 500 microCT med användning av identiska förvärvsparametrar. Voxelstorleken i båda datamängderna är 13,5 µm. (A, C och E) Översiktsbilder av den ofärgade musleverlobulen som representerar vyerna längs de kartesiska axlarna. (B, D och F) Översiktsbilder av samma musleverleverlobulprov i (A, C och E) efter färgning som representerar vyerna längs de kartesiska axlarna. Anatomiska strukturer som kärlsystemet visualiseras. Kreditera: Vetenskapliga rapporter , doi:https://doi.org/10.1038/s41598-018-36067-y.
Under den första diagnosen i klinisk patologi, cellkärnorna och cytoplasman är av betydelse. Nästan varje histologiskt prov färgas därför ofta via standard hematoxylin och eosin (H &E) protokoll för att identifiera kärnorna och cytoplasman. Men standarder för hematoxylin-fläcken är inte fastställda och många varianter av protokollet finns på grund av olika vävnadstyper och/eller förbehandlingsparametrar. Som ett resultat, Müller et al. introducerade ett hematinbaserat färgningsprotokoll, speciellt utvecklad för CT, för att möjliggöra direkt 3D-visualisering av cellkärnor i mjukvävnadsprover. Den kraftfulla potentialen hos microCT eller nanoCT i kombination med röntgen lämpliga fläckar kommer att möjliggöra framtida insikter i vävnadsorganisation för att förstå sjukdomar inklusive artros och cancer, vid den cellulära nanoarchitecturen.
När man utvecklar den nya röntgen lämplig, hematinbaserad fläck, det vanliga Mayers hematoxylin och Wiegerts järnhematoxylin ingick i dess sammansättning. Färgningsexperimenten utfördes på vävnaden i musleverlobobuli, används för röntgen CT-avbildning därefter. Det optimerade färgningsprotokollet innehöll fem steg som började med kontrollerad försurning av mjukvävnadsprover under fixering. Mjukvävnaden bereddes på molekylär nivå för att färgas med hematein-bly (II) -komplexet.
I sin verkningsmekanism, forskarna visade förstärkt jonisk interaktion mellan det positivt laddade hematein -bly (II) -komplexet och den negativt laddade fosfatstammen i deoxyribonukleinsyran (DNA). Den kemiska reaktionen säkerställde högre ackumulering av färgämnet i cellkärnorna genom att bilda ett hematein bly (II) DNA -komplex, som ett röntgen lämpligt medel.

NanoCT-data (A – C) i jämförelse med det histologiska mikroskopiska objektglaset (D) som härrör från samma musleverlobobul efter applicering av det hematinbaserade röntgenfärgningsprotokollet. Tydlig visualisering av de större hepatocytcellkärnorna och de mindre cellkärnorna som Kupffer-celler och SEC:er i vitt (A – C) eller mörklila (D) och BC-nätverket som visas i svart (AC) eller vitt (D) uppnåddes, respektive. (A) Volymen av intresse (VOI) som markerar de två nanoCT -segmenten som visas i (B, blå ram) och (C, orange ram). (B, C) Representativa individuella nanoCT -skivor som anges i VOI från (A). (B) och (C) är placerade ortogonala mot varandra. BC -nätverkets orientering, som bildas av hepatocyterna ses, dvs mer horisontellt arrangemang ses i (B) och en mer vertikal inriktning i (C). Skivans tjocklek på nanoCT är 580 nm. (D) Representativ histologisk mikroskopisk bild med en tjocklek av 3 µm erhållen från samma muslever-lobulprov efter applicering av hematinbaserad fläck och inbäddning i ett paraffinblock. Kreditera: Vetenskapliga rapporter , doi:https://doi.org/10.1038/s41598-018-36067-y.
För att jämföra färgningseffekten, musleverens lobulvävnad avbildades med microCT före färgning, följt av avbildning efter hematein-protokollbaserad färgning. Färgningsprocessen skedde i två steg och den önskade kontrastförbättringen uppnåddes som förväntat efter färgning. Resultaten observerades med hjälp av microCT -översikten för att visa distinkta anatomiska strukturer, inklusive kärlsystemet. Färgningen var homogen i hela musleverloben, till skillnad från tidigare exempel i stora levervävnadsprover. 3D -avbildningsprocessen möjliggjorde åtkomst till en serie CT -skivor i godtyckliga plan. Vidare, till skillnad från konventionell 2D-histologi (med paraffininbäddad mjukvävnad), mjukvävnaden kunde ses från olika vinklar.
Vävnaden undersöktes därefter på subcellulär nivå med mindre bitar av samma leverlob, som dissekerades och analyserades med hjälp av nanoCT. De visualiserade resultaten visade regioner med volym av intresse (VOI), cellkärnor i hepatocyterna och kärnor från andra celltyper (Kupffer -celler och sinusformade endotelceller). Svarta hela strukturer representerade gallkanal (BC) -nätverket medan de mörkare gråvärdena indikerade cytoplasman i levervävnadsprovet. BC -nätverkets orientering observerades också. Vävnaden undersöktes sedan med konventionell histologi, med mycket tunna mikroskopiska objektglas utan någon annan färgning förutom den hematinbaserade fläcken som appliceras. Den konventionella tekniken bekräftade på samma sätt morfologin hos hepatocyter och andra celltyper (kärnor färgade i mörklila), medan BC -nätverket var färgat i vitt.
3D -kärnor och analys av olika cellkärnor som finns i musens levervolym av intresse (VOI). Kreditera: Vetenskapliga rapporter , doi:https://doi.org/10.1038/s41598-018-36067-y.
Forskarna bekräftade jämförelsevis 3D -datarekonstruktionens noggrannhet i studien med tidigare undersökningar. När det hematinbaserade förfarandet åter applicerades i konventionella 2D-histologiska undersökningar, forskarna applicerade också en vanlig motfläck, eosin Y -specifik, till cellcytoplasman till vävnaden. I resultaten, cellkärnorna förblev lila medan cytoplasman tog upp den rosa fläcken. På det här sättet, forskarna autentiserade den kärnspecifika hematinbaserade färgningskapaciteten med standardhistologi också.
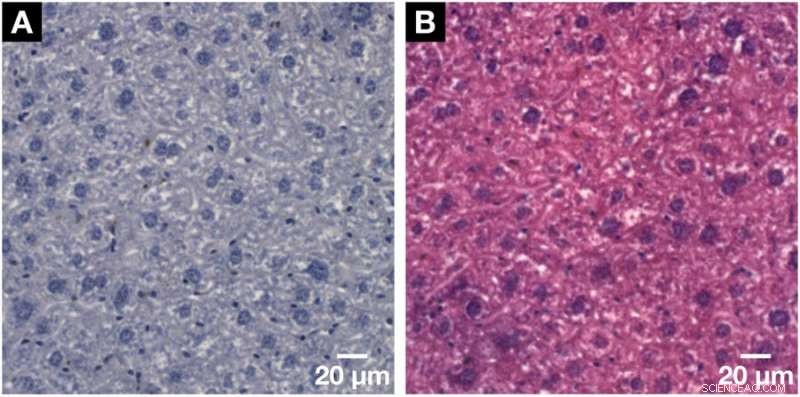
Demonstration av den histologiska kompatibiliteten för för röntgenmikroCT och nanoCT utvecklade hematinbaserad färgningsmetod med konventionell 2D-histologi. (A) Representativ histologisk mikroskopisk bild med en tjocklek av 3 µm erhållet från samma musleverlobobulprov efter applicerad hematinbaserad färgning och inbäddning i ett paraffinblock. Tydlig visualisering av de större hepatocytcellkärnorna och de mindre cellkärnorna som Kupffer -celler och SEC i mörklila och BC -nätverket visas i vitt. (B) Kompatibiliteten med standardmotfläcken för eosin Y visades på en efterföljande mikroskopisk bild som ses i (A). Cellkärnorna visas i lila bredvid cytoplasman i rosa vilket resulterar i en typisk H &E-färgad mikroskopisk bild av ett mjukvävnadsprov. Kreditera: Vetenskapliga rapporter , doi:https://doi.org/10.1038/s41598-018-36067-y.
Hematinbaserat färgningsprotokoll hjälpte högupplöst CT-visualisering för cellkärnor i mjukvävnad vid submikronområdet, hittills inte möjligt med andra färgningsmetoder som kombinerades med microCT -teknik. Framtida histopatologiska studier kan eventuellt eliminera tidskrävande förberedelseprocedurer och förlust av vävnadsprover (enligt standardhistologi) för att erhålla individuella vävnadsskivor via 3D-undersökning av en hel VOI, som visas i föreliggande studie. Möjligheten att screena ett större prov för onormala cellkärnor kan hjälpa patologer att identifiera inflammationsområden för att bedöma sjukdomens etiologi och progression.
Färgningsprotokollet är enkelt och reproducerbart, lämplig för helorgan CT-färgning, i kombination med 3D-visualisering och djupgående, icke-destruktiv analys av mjukvävnadsprover. De färgämnen som anges i protokollet är lättillgängliga, medan CT kombinerat röntgen lämpligt protokoll möjliggör större sofistikering för mjukvävnadsprov analyser. Steg i färgningsprotokollet kommer att kräva ytterligare optimering med olika vävnadstyper och i olika applikationer, inklusive 3D -histologi, utvecklings- och strukturbiologiska studier i labbet.
© 2018 Science X Network