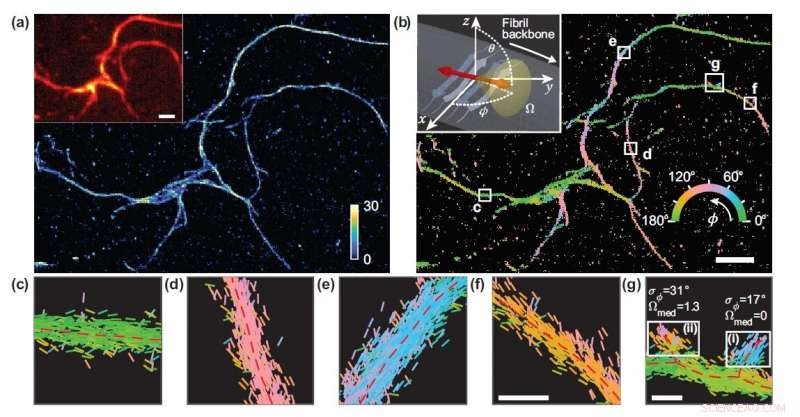
Forskare utvecklade en mikroskopiteknik som mäter placeringen och orienteringen av enstaka molekyler och använde den för att studera de strukturella detaljerna för amyloidproteinaggregat. (a) Enmolekylär lokaliseringsmikroskopibild av ett nätverk av amyloidaggregat. (b) Bild som visar Nilenröd bindningsorientering till amyloidytor, färgkodade enligt den genomsnittliga orienteringen uppmätt i varje fack. (c-g) Individuella orienteringsmätningar lokaliserade längs fibrilskelett i de vita rutorna i (b). Linjerna är orienterade och färgkodade enligt riktningen för den uppskattade vinkeln. Horisontella vita skalstänger är längdmarkörer, 1 mikron i (a), (b) och 100 nm i (f), (g). Upphovsman:Tianben Ding, Tingting Wu och Matthew D. Lew, Washington University i St. Louis
Neurodegenerativa sjukdomar som Alzheimers och Parkinsons åtföljs ofta av amyloidproteiner i hjärnan som har blivit klumpade eller felaktiga. En nyutvecklad teknik som mäter orienteringen av enstaka molekyler möjliggör användning av optisk mikroskopi, för första gången, att avslöja nanoskala detaljer om strukturerna för dessa problematiska proteiner.
Forskare från Washington University i St. Louis beskriver sitt nya tillvägagångssätt i Optica , The Optical Society's journal.
"Neurodegenerativa sjukdomar som Alzheimers och Parkinsons sjukdomar är ledande dödsorsaker över hela världen, "sa Tianben Ding, medförfattare till den nya artikeln. "Vi hoppas att vår enkelmolekylorienteringsbildmetod kan ge nya insikter om amyloidstruktur och möjligen bidra till framtida utveckling av effektiva läkemedel mot dessa sjukdomar."
Biologiska och kemiska processer i hjärnan drivs av komplicerade rörelser och interaktioner mellan molekyler. Även om de flesta amyloidproteiner kan vara giftfria, felveckning av några få kan så småningom döda många neuroner.
"Vi behöver bildteknik som kan titta på dessa molekylära rörelser i levande system för att förstå de grundläggande biologiska mekanismerna för sjukdomar, "förklarade Matthew D. Lew, ledare för forskargruppen. "Amyloid- och prionsjukdomar som Alzheimers, Parkinsons och diabetes är våra första mål för denna teknik, men vi ser att den tillämpas på många andra områden också. "
Välj det bästa mikroskopet
Lews lab har utvecklat flera enkelmolekylära superupplösta mikroskopimetoder som mäter orienteringen och placeringen av fluorescerande molekyler fästa vid enstaka proteiner. Orienteringsinformationen erhålls genom att inte bara mäta platsen för fluorescens i provet utan även egenskaper hos det ljuset, som polarisering, som vanligtvis ignoreras i de flesta andra mikroskopimetoder.
I deras Optica artikel, forskarna beskrev en prestandamätning de utformade för att karakterisera hur känsligt olika mikroskop kan mäta orienteringar av fluorescerande molekyler. Med den nya prestandaindikatorn, forskarna fann att ett mikroskop som delar upp fluorescensljus i två polarisationskanaler (x och y) ger överlägsna och praktiska orienteringsmätningar.
"Mätvärdet som vi utvecklat beräknar prestandan för en viss mikroskopdesign 1, 000 gånger snabbare än tidigare, "sa Tingting Wu, medförfattare till verket. "Genom att mäta orienteringarna för enstaka molekyler bundna till amyloidaggregat, det valda mikroskopet gjorde det möjligt för oss att kartlägga skillnader i amyloidstrukturorganisation som inte kan detekteras av standardiserade lokaliseringsmikroskop. "
Eftersom det inte finns någon artificiell koppling mellan de fluorescerande sonderna och amyloidytorna, sondernas bindningsorientering till amyloidytorna förmedlar information om hur amyloidproteinet i sig är organiserat. Forskarna kvantifierade hur orienteringen av fluorescerande molekyler varierade varje gång en fästes till ett amyloidprotein. Skillnader i dessa bindningsbeteenden kan hänföras till strukturskillnader mellan amyloidaggregat. Eftersom metoden ger information om en enda molekyl, forskarna kunde observera nanoskala skillnader mellan amyloidstrukturer utan att i genomsnitt ta ut detaljer om lokala funktioner.
Möjligheter för långtidsstudier
"Vi planerar att utöka metoden för att övervaka förändringar av nanoskala inom och mellan amyloidstrukturer när de organiseras över timmar till dagar, "sa Ding." Långsiktiga studier av amyloidaggregat kan avslöja nya samband mellan hur amyloidproteiner organiseras och hur snabbt de växer eller upplöses spontant. "
Forskarna noterar att upplägget som de använde för orienterings-lokaliseringsmikroskopi bestod av kommersiellt tillgängliga delar som är tillgängliga för alla som utför enmolekylär superupplösande mikroskopi. Deras analyskod finns på https://github.com/Lew-Lab/RoSE-O.
"I optisk mikroskopi och avbildning, forskare och ingenjörer har flyttat gränserna för bildbehandling för att vara snabbare, sonda djupare och ha högre upplösning, "sa Lew." Vårt arbete visar att man kan belysa grundläggande processer i biologin genom, istället, med fokus på molekylär orientering, som kan avslöja detaljer om biologins inre funktioner som inte kan visualiseras med traditionell mikroskopi. "