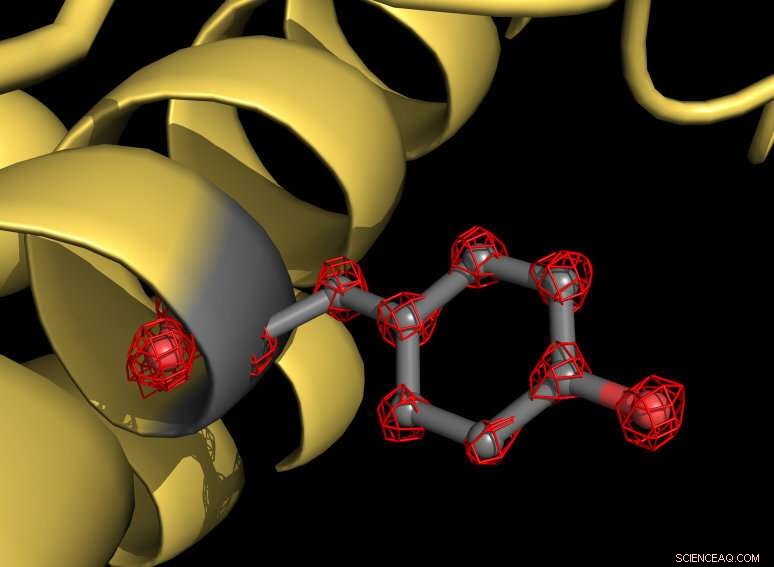
En del av apoferritinproteinet (gult) med en tyrosinsidokedja markerad i grått. Aminosyran tyrosin består av flera atomer som är individuellt igenkännbara i strukturen (röda rutnätstrukturer). Upphovsman:MPI f. Biofysisk kemi/ Holger Stark
Holger Stark från Max Planck -institutet för biofysisk kemi i Göttingen och hans team har brutit en avgörande upplösningsbarriär i kryo -elektronmikroskopi. För första gången, hans grupp lyckades observera enskilda atomer i en proteinstruktur och ta de vassaste bilderna någonsin med denna metod. Sådana detaljerade insikter gör det lättare att förstå hur proteiner gör sitt arbete eller orsakar sjukdomar i den levande cellen. Tekniken kan också användas i framtiden för att utveckla nya läkemedel.
Sedan utbrottet av COVID-19-pandemin har forskare runt om i världen har löst 3D-strukturer av viktiga nyckelproteiner av det nya coronaviruset. Deras gemensamma mål är att hitta dockningsplatser för en aktiv förening som effektivt kan bekämpa patogenen.
En metod som används för detta är kryo-elektronmikroskopi (cryo-EM), som kan användas för att synliggöra tredimensionella strukturer av biomolekyler. Eftersom dessa är strukturellt mycket flexibla är detta ingen lätt uppgift. För att fånga de suddiga molekylerna utan att skada dem, de kyls ner extremt snabbt, eller chockfryst så att säga. De frysta proverna bombarderas därefter med elektroner, och de resulterande bilderna spelas in. Med hjälp av dessa, molekylernas tredimensionella struktur kan sedan beräknas. Tre pionjärer inom denna teknik, Jacques Dubochet, Joachim Frank, och Richard Henderson, fick Nobelpriset i kemi för utvecklingen av cryo-EM 2017.
Världsrekord för upplösning gör det möjligt att se enskilda atomer i proteiner
Starks grupp har nu brutit cryo-EM-upplösningsbarriären med ett unikt cryo-elektronmikroskop som nyligen utvecklats av detta team. "Vi utrustade vår enhet med ytterligare två elektronoptiska element för att ytterligare förbättra bildkvaliteten och upplösningen. Dessa säkerställer att bildfel i optiska linser, så kallade aberrationer, spelar ingen roll längre, "förklarar Max Planck -regissören. Hans doktorand Ka Man Yip tillägger:" Elektronmikroskop är optiska instrument och liknar fysiskt en kamera. Aberrationerna hos ett elektronmikroskop stör i cryo-EM på ungefär samma sätt som hos en kamera i fotografering. För en mycket förbättrad bildkvalitet var det därför avgörande att undvika dessa aberreringsfel. "
Med det nya mikroskopet, forskarna har tagit mer än en miljon bilder av proteinet apoferritin för att kartlägga molekylstrukturen med en upplösning på 1,25 ångström. En ångström motsvarar en tiondel av en miljonedel av en millimeter. "Vi visualiserar nu enstaka atomer i proteinet - en milstolpe inom vårt område, "förklarar strukturbiologen Stark." För oss, det var som att sätta superglasögon i mikroskopet. Den nya strukturen avslöjar detaljer som aldrig setts tidigare:Vi kan till och med se densiteten för väteatomer och kemiska modifieringar av en atom. "
Cryo-EM:s stora potential för avbildning av högupplösta 3D-proteinstrukturer demonstrerades också av kollegor vid Medical Research Council Laboratory of Molecular Biology i Cambridge (Storbritannien). De uppnådde en lika hög upplösning med ett annat tillvägagångssätt. "Det är nu tänkbart att cryo-EM i framtiden kommer att kunna uppnå även subatomära upplösningar, säger forskaren.
Grund för strukturbaserad läkemedelsdesign
Men vad är fördelen med att kunna studera en proteinstruktur med en sådan aldrig tidigare skådad atomupplösning? För att förstå hur en konstgjord maskin fungerar, man måste observera dess komponenter direkt på jobbet. Detta gäller även proteiner - levande cellers nanomaskiner. För att få en uppfattning om hur de utför sina uppgifter, man måste veta den exakta positionen för alla atomer i proteinet.
Sådana detaljerade insikter är också relevanta för strukturbaserad läkemedelsdesign. Föreningar för läkemedel anpassas på ett sätt som de binder till virala proteiner, till exempel, och blockera deras funktion. Men vad är den bakomliggande hämningsmekanismen? Forskare kan bara belysa och förstå detta om de på atomnivå kan observera hur en förening och ett viralt protein interagerar. Sådana nya insikter hjälper till att förbättra molekyler för läkemedel och minska biverkningar. "Med att bryta denna cryo-EM-upplösningsbarriär, tekniken har nått en nivå där fördelarna med läkemedelsutvecklingen är direkt synliga, säger Stark.