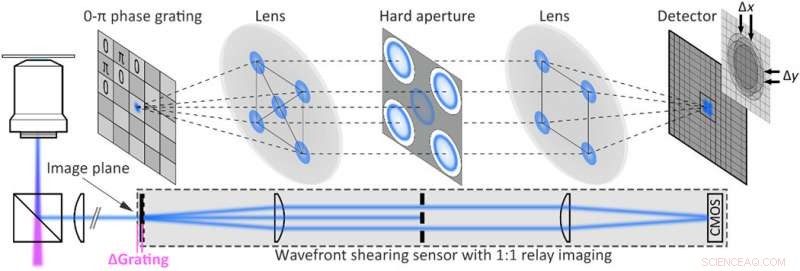
Experimentell implementering av single-shot fluorescensholografi. Fluorescensskjuvningsholografiinställning erhållen genom att utöka ett fluorescensvidfältsmikroskop med en vågfrontssensor som består av ett 2D 0-π fasgitter och ett reläbildsystem monterat vid mikroskopets utgångsport. Den hårda bländaren blockerar alla utom de första diffraktionsordningarna. Kredit:Science Advances, doi:10.1126/sciadv.abc2508
Biologer använder vanligtvis fluorescensmikroskopi på grund av teknikens molekylära specificitet och superupplösning. Dock, metoden undanhålls av avbildningsgränser. I en ny rapport om Vetenskapens framsteg , Matz Liebel och ett forskarteam vid Barcelona Institute of Science and Technology och Massachusetts General Hospital i Spanien och USA rapporterade en avbildningsmetod för att återställa hela det elektriska fältet av fluorescerande ljus med en molekylär känslighet. Teamet experimenterade med konceptet digital holografi för snabb fluorescensdetektion genom att spåra den tredimensionella (3-D) banan för individuella nanopartiklar med en upplösning i planet på 15 nanometer. Som proof-of-concept biologiska tillämpningar, forskarna avbildade 3D-rörelsen av extracellulära vesiklar inuti levande celler.
Nanoleverans i levande vävnad
I det här arbetet, Liebel et al. utvecklade fluorescensholografibaserad 3D-partikellokalisering över extracellulära vesiklar inuti levande celler och observerade starkt instängda vesiklar med perioder av aktiv transport. Att leverera godstransporter in vivo är för närvarande en betydande utmaning, för att aktivt implementera minimalt invasiva nanomedicinska plattformar. Nanopartiklar (NP) och extracellulära fordon kan konstrueras som lovande kandidater för att leverera som fordon, men forskare förstår ännu inte den exakta resan för sådana enheter i levande vävnad.
För att övervinna dessa utmaningar, de måste utveckla brett fält tredimensionella (3-D) enpartikelavbildningsmetoder för att spåra enskilda partiklar samtidigt som de reser till sin avsedda destination. Forskarlag hade tidigare implementerat holografiska metoder för mikroskopi, även om inkoherensen av fluorescerande ljus inte är väl lämpad för levande celler eller enmolekylavbildning. I jämförelse, skjuvningsinterferometri är en lovande metod för att utföra engångsinspelning av dynamiska processer. Den underliggande idén bakom skjuvningsinterferometri inkluderar självinterferens för att få tillgång till fasgradienter ner till en enskild fotonnivå för att uppnå single shot fluorescensholografi. De mekanismer som utvecklats i detta arbete tjänar därför till att observera intracellulär translokation över mikrometerlängdsskalor för att ge biologer djupare insikt om intracellulära mekanismer.

Arbetsflöde för rekonstruktion av elektriska fält. (A) Experimentellt erhållen bild av ofokuserade 200-nm fluorescerande pärlor som visar skjuvningsinducerad rumslig modulering av punktspridningsfunktionerna (PSF). (B) Snabb Fourier-transformation (FFT) av (A) tillåter isolering av interferensvillkoren av intresse i både x- och y-dimensionen med hjälp av hård aperturisolering och växling till nollfrekvens. (C) Invers snabb Fourier-transformation (iFFT) av termerna isolerade från (B) ger de önskade fasgradienterna. (D) Analytisk 2D-integration med en Poisson-lösare ger den råa fasbilden. (E) Fasskalning, för att ta hänsyn till avståndet mellan galler och kamerachip, följt av aberrationskorrigering resulterar i slutfas- och amplitudbilder. Alla skalstaplar är identiska, och 0-2π fasinpackningen är endast för visualiseringsändamål; den oinpackade informationen erhålls direkt. Kredit:Science Advances, doi:10.1126/sciadv.abc2508
Bildprincip och systemvalidering för 3D-partikelspårning
Teamet använde ett bredfältsfluorescensmikroskop med en vågfrontsskjuvningssensor bestående av ett reläbildsystem. Geometrin för uppställningen säkerställde att fasgradienter som inte var noll mättes och tillät Liebel et al. att utföra självinterferens med en foton över en hel bild. Teamet avbildade fluorescerande polystyrenpärlor som ofokuserade 200 nm-partiklar och extraherade intensitetsinformationen som argumentmodul för de filtrerade bilderna för fasgradientextraktion. Efter att ha observerat det fulla elektriska fältet, de använde Fourier-optik för att korrigera komplexa spridningsinducerade aberrationer eller konstruera bilder på valfritt plan. Teamet fokuserade på 3D-lokaliseringsexperiment som kräver återställning av den exakta positionen för en sändare av intresse över alla dimensioner, inklusive Z-planet. Beräkningsfokuseringsansträngningar indikerade den exakta förmågan att bestämma 3D-positionen för flera fritt spridande fluorescerande partiklar.
Testa beräkningsfokuseringsbanan
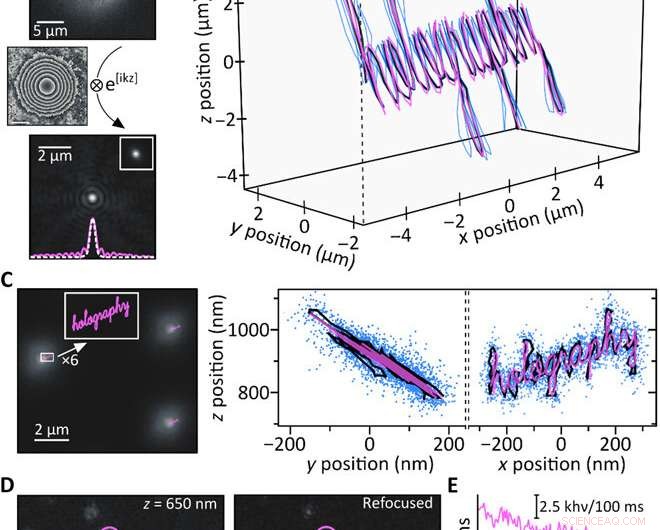
Proof-of-concept experiment. (A) En 200-nm fluorescerande pärla inspelad 4,4 μm över fokus (överst) är beräkningsmässigt omfokuserad (nederst). Insatsen visar en experimentellt erhållen fokusbild av samma partikel tillsammans med ett snitt genom respektive PSF:er (vit streckad:i fokus; rosa, solid:omfokuserad). (B) Samtidig 3D-spårning av tre 200-nm fluorescerande pärlor genom att flytta provet med ett piezo-steg längs en känd bana (rosa:piezorörelse; blå:rekonstruerade banor för individuella pärlor; svart:medelbana). De individuella banorna är överlagrade i x/y för tydlighetens skull; z =0 μm motsvarar att en partikel är i fokus. (C) Avsedda sub-diffraktionsbegränsade piezobanor (rosa) jämfört med en typisk bild erhållen 900 nm ovanför fokus (vänster). De resulterande y/z och x/z medelvägprojektionerna (svart) överensstämmer väl med piezobanan (rosa), och blå prickar visar alla positioner som erhållits genom att samtidigt spåra 17 individuella fluorescerande pärlor (höger). Histogrambaserad analys av lokaliseringsprecisionerna ger σx/σy =15 nm och σz =21,5 nm, respektive (not S7). (D) Enstaka ATTO647N-molekyler inspelade ur fokus (vänster) är framgångsrikt beräkningsfokuserade (mitten). De representativa områdena för fluorescensemission (rosa, lila, och blå) visar fotoblekning i ett steg som förväntat för enstaka sändare. (E) Fotoblekning tidsspår av de tre regionerna markerade i (D); den streckade linjen indikerar bakgrundsnivån. Kredit:Science Advances, doi:10.1126/sciadv.abc2508
För att testa beräkningsresonemang bakom installationen, Liebel et al. genererade en känd 3-D-bana och flyttade ett prov innehållande immobiliserade fluorescerande pärlor - samtidigt som bilder spelades in längs vägen. De återvann fas- och amplitudinformationen och bestämde 3D-positionerna för enskilda partiklar med hjälp av numerisk utbredning. För att kvantifiera det tillgängliga Z-intervallet, de defokuserade experimentellt enskilda partiklar och omfokuserade sedan bilderna beräkningsmässigt för att erhålla artefaktfria mätningar över ett Z-område på cirka åtta µm. Det är viktigt att säkerställa exakt lokalisering i nanoskala över mikrometerlängdsskalor i 3-D för att avbilda spridande nanoskala partiklar. Fluorescensholografi uppfyllde dessa krav. Som proof of concept, forskarna avbildade ordet "holografi, " där varje enskild ingångsbokstav mätte mindre än 50 nm i bredd för att få en välupplöst utdata, bekräftar superupplösningskapaciteten hos fluorescerande holografi.
Enkelmolekylavbildning och cellulärt upptag av nanopartiklar
Teamet visade hur fluorescensholografi fungerade under biologiskt viktiga superupplösningsförhållanden genom att mäta ett prov som består av individuella molekyler. Trots markant minskade fluorescensintensiteter i experimentuppställningen, teamet erhöll beräkningsfokusering till diffraktionsgränsen även för fotonnivåer så låga som 10 4 fotoner. De visualiserade intracellulär handel med oorganiska nanopartiklar och extracellulära vesiklar med hjälp av systemet. Som ett modellsystem, de använde fluorescensmärkta guld nanorods som är inerta och därför utan störningar med cellulära funktioner för att ackumuleras i cytoplasman, vilket verifierats med mörkfältsbilder av levande celler. Teamet följde partiklarnas banor genom att spela in time-lapse fluorescensbilder och extraherade fas- och amplitudtermerna. De vitt varierande punktspridningsfunktionerna (PSF) indikerade närvaron av nanorods vid olika Z-positioner i förhållande till fokalplanet.

3D-fluorescensspårning i levande celler. (A) Typiskt spårningsexperiment med levande celler med en partikel. (B) Mättade fluorescensbilder (rosa) överlagrade på motsvarande ljusfältsbilder av apnjurceller. (C) Fluorescensamplitud (vänster) och fas (höger) erhållna genom att avbilda cellprov B. Alla filmer spelas in med 100 ms exponeringstid över totalt 100 bildrutor vid en avbildningsdriftcykel på 1/20 för att möjliggöra långtidsverkan bildbehandling. För att ta hänsyn till de stora skillnaderna i ljusstyrka mellan partiklar som är i fokus och ofokuserade, vi visar den normaliserade amplituden snarare än fluorescensintensiteten och begränsade skalan till 0,5 med maxvärdet på 1. Insättningar:original, oinpackad, fasbilder som framhäver den konvexa/konkava krökningen av partiklar över/under bildens fokalplan. (D) Jämförelser av ursprungliga amplitudbildsegment erhållna från (C) med bilder erhållna genom beräkningsutbredning av -2 μm (överst) och 2 μm (botten). (E) 3D-banor erhållna genom fluorescensholografi för partiklar som diffunderar inuti levande celler. Varje enskild bana har en individuell skala, och z-positionen är färgkodad. Kredit:Science Advances, doi:10.1126/sciadv.abc2508
Teamet utförde 3D-lokalisering av varje enskild nanorod i cellen och rekonstruerade partikelbanor över 100 observationsramar för att få sex representativa kategorier, där vissa partiklar var orörliga under de 200 sekunderna av observationstid, medan andra spred sig fritt över flera mikrometer. De återstående partiklarna visade både bundna och diffuserande tillstånd. På det här sättet, den underliggande fluorescensholografimetoden kunde exakt bestämma 3D-positioner.
Cellulärt upptag och aktiv transport av extracellulära vesiklar
Liebel et al. studerade sedan den aktiva 3-D-transporten av extracellulära vesiklar (EV) inuti levande celler genom att inkubera HeLa-celler med fluorescensmärkta EV:er. De förvärvade fluorescerande hologram var fjärde sekund för att rekonstruera 3D-banor av individuella elbilar genom en kombination av automatiserade och manuella banor, länkar 3-D EV-positionerna. Liebel et al. överlagrade time-lapse amplitudprojektioner av fluorescerande hologram med samtidigt inspelade ljusfältsbilder av enskilda celler, för att visa hur de flesta elbilar var lokaliserade i kanten av de vidhäftande cellerna. Observationerna och beräkningarna antydde att elbilarna var instängda i ett område, begränsa deras rörelse till en specifik volym; troligen tillhörande det cellulära cytoskelettet.
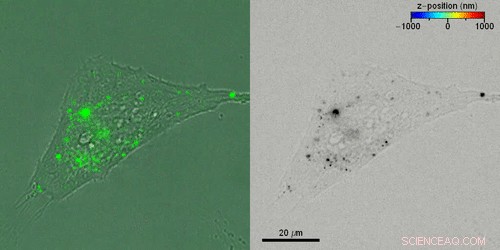
Rekonstruera 3D-banorna för individuella extracellulära vesiklar (EV) inuti levande celler. Kredit:Science Advances, doi:10.1126/sciadv.abc2508
Syn
På det här sättet, Matz Liebel och kollegor utarbetade en fluorescensholografimetod med stort synfält för att tillåta 3D-spårning av en partikel över ett Z-område på ungefär åtta mikrometer. För att bevisa detta koncept, teamet implementerade en enkel experimentell installation med en optimerad fotongenomströmning. De optimerade funktionerna gjorde det möjligt för fluorescensholografi att vara en idealisk metod för att studera partikelspårning i realtid. Teamet visade 3D-spårning av en partikel och observerade rörelsen av objekt i nanoskala i levande celler, såsom fluorescensmärkta guld nanorods och EVs (extracellulära vesiklar). Medan guld nanorods endast aggregerade i cytoplasman utan internalisering i kärnan, elbilarna ackumulerades vid kanterna av vidhäftande celler i en trängseleffekt. Liebel et al. förvänta sig att utföra ytterligare färgning för att identifiera det intracellulära cytoskelettet, därigenom kopplar den intracellulära arkitekturen till rörelsen av extracellulära vesiklar. Dessa ansträngningar kommer att belysa de exakta mekanismerna för lasttransport och partikelinternalisering inuti celler med viktiga tillämpningar inom nanomedicin för att svara på kritiska frågor inom biologi och medicin. Mekanismen är lika lämpad för att utföra andra volymetriska avbildningsmetoder för att spåra inuti vävnader och för biokemisk kalciumavbildning.
© 2020 Science X Network