UC Santa Barbara-forskare bygger ut repertoaren av kemiska reaktioner med hjälp av ljus. I en artikel publicerad i tidskriften Nature , kemiprofessor Yang Yang och medarbetare vid University of Pittsburgh rapporterar en metod som använder fotobiokatalys för att producera icke-kanoniska (inte naturligt förekommande) aminosyror som är värdefulla byggstenar för peptidterapi, bioaktiva naturprodukter och nya funktionella proteiner.
"Så många ansträngningar har gjorts inom biokatalysområdet, och vi är nu vid en punkt där vi rationellt kan designa helt nya enzymatiska reaktioner som saknar motstycke i varken kemi eller biologi," sa Yang.
De flesta ansträngningar inom området biokatalys, eller accelerationen av kemiska reaktioner via enzymer – naturens privilegierade katalysatorer – har lutat åt att optimera naturliga enzymfunktioner som är användbara för syntetisk kemi, eller att återanvända naturliga enzymer för att underlätta onaturliga reaktioner kända för syntetisk kemi. Trots ett decennium av omfattande forskning finns det bara en handfull exempel på enzymatiska reaktioner som är både nya för naturen och nya för syntetisk kemi.
"Vad vi är intresserade av är i huvudsak att upptäcka helt nya enzymatiska reaktioner och generella sätt för enzymkatalys," tillade Yang.
Gå in i fotobiokatalys, där ljus används för att excitera enzymer för att generera energi (ofta i form av fria radikaler) för att omvandla en molekyl till en annan. Fotobiokatalys, som är ett relativt ungt kemiområde, drar fördel av selektiviteten och effektiviteten hos enzymer och kombinerar det med ljusets mångsidighet och hållbarhet för att skapa nya processer, och i det här fallet icke-kanoniska aminosyror.
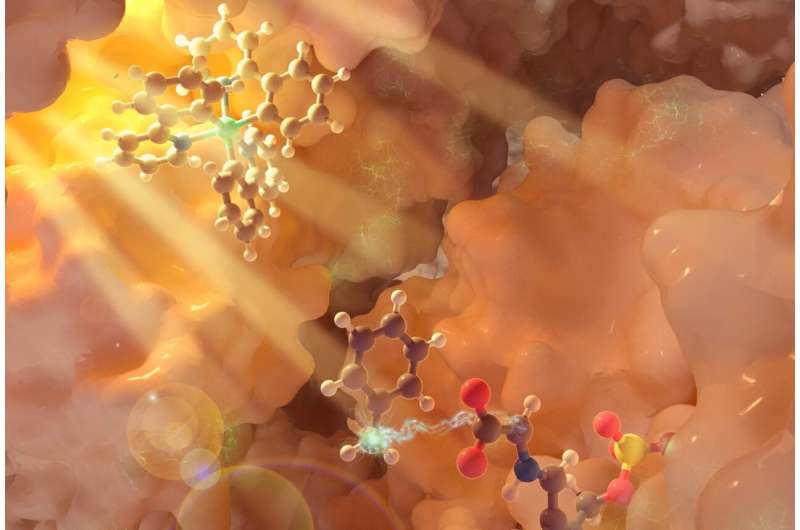
För denna studie fokuserade forskargruppen på pyridoxalfosfat (PLP)-beroende enzymer, en stor familj av enzymer som ansvarar för metabolismen av aminosyror. Teamet utvecklade en interagerande, trippel katalytisk cykel där en fotokatalysator - en iridiumbaserad förening - exponeras för ljus, vilket initierar en process som genererar en övergående fri radikal, medan en andra cykel med ljus regenererar fotokatalysatorn.
Samtidigt modifierar biokatalyscykeln med användning av ett PLP-enzym aminosyrasubstratet via en serie aktiveringssteg som är unika för PLP-biokemi. Den fria radikalen som genereras från fotokemi kommer in i bilden här, kommer in i enzymets aktiva plats och engagerar den enzymatiska mellanprodukten för att möjliggöra ny kemi. Detta samarbete mellan enzymet och fotokatalysatorn möjliggör produktion av en icke-kanonisk aminosyraprodukt.
Förändringen av – i det här fallet – vanliga aminosyrors molekylära strukturer lägger till nya egenskaper och möjligheter till dessa syror. Genom att skapa en ny kol-kol-bindning till det kritiska "alfa-kolet" i aminosyran, säger Yang, blir det möjligt att använda denna "ryggrad" för att designa en rad nya aminosyror som i sin tur kan ge nya, unika och önskvärda funktioner som bas för nya terapier och naturliga produkter.
"Detta är den första demonstrationen av pyridoxisk biokatalys via radikalmedierad alfafunktionalisering av rikliga aminosyrasubstrat," påpekade Yang.
Dessutom är den mycket effektiva processen både stereoselektiv, vilket innebär att den kan välja en föredragen tredimensionell "form" av den resulterande aminosyran, och den eliminerar de extra stegen att lägga till och ta bort "skyddande grupper" eller föreningar som maskerar vissa reaktiva områden på molekyler för att förhindra oönskade kemiska reaktioner i dessa regioner.
"Vi har upptäckt intressanta interaktioner mellan fotokatalysatorn och enzymet", säger Yang, vars grupp studerar hur man ytterligare kan förbättra interaktionen mellan de två katalysatorerna. "Jag tror att detta kommer att leda till ny grundläggande vetenskap, både ur syntetisk kemi och även enzymologisk synvinkel."