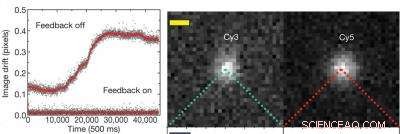
Grafen till vänster visar att med det aktiva återkopplingssystemet avstängt finns en upplösningsdrift på cirka 0,3 pixlar eller 19 nanometer, men med återkopplingssystemet hålls upplösningen bättre än 0,01 pixlar, eller cirka 0,64 nanometer. Bilden till höger visar enskilda cyanin (Cy) fluorescerande färgämnesmolekyler - Cy3 och Cy5 - som används för att märka 20 baspar av dubbelsträngat DNA. Kredit:Med tillstånd av Steven Chu forskargrupp
Konventionell visdom säger att optisk mikroskopi inte kan användas för att "se" något så litet som en enskild molekyl. Men som det är vanligt, smart vetenskap har återigen kullkastat konventionell visdom. Energiminister, Nobelpristagaren och tidigare chef för Lawrence Berkeley National Laboratory (Berkeley Lab) Steven Chu ledde utvecklingen av en teknik som möjliggör användning av optisk mikroskopi för att avbilda objekt eller avståndet mellan dem med upplösningar så små som 0,5 nanometer - hälften av en miljarddels meter, eller en storleksordning mindre än den tidigare bästa.
"Förmågan att få subnanometerupplösning i biologiskt relevanta vattenmiljöer har potential att revolutionera biologin, särskilt strukturbiologi, " säger sekreterare Chu. "En av motiven för detta arbete, till exempel, var att mäta avstånd mellan proteiner som bildar multidomäner, mycket komplexa strukturer, såsom proteinsammansättningen som bildar det humana RNA-polymeras II-systemet, som initierar DNA-transkription."
Sekreterare Chu är medförfattare till en artikel som nu visas i tidskriften Natur som beskriver denna forskning. Uppsatsen har titeln "Subnanometer single-molecule localization, registrering och avståndsmätningar." De andra författarna är Alexandros Pertsinidis, en postdoktoral forskare och medlem av Chus forskargrupp vid University of California (UC) Berkeley, som nu är biträdande professor vid Sloan-Kettering Institute, och Yunxiang Zhang, medlem i Chus forskargrupp vid Stanford University.
Enligt en fysiklag känd som "diffraktionsgränsen, " den minsta bilden som ett optiskt system kan lösa upp är ungefär halva våglängden av ljuset som används för att producera den bilden. För konventionell optik, detta motsvarar cirka 200 nanometer. Som jämförelse, en DNA-molekyl mäter cirka 2,5 nanometer i bredd.
Medan icke-optiska bildsystem, såsom elektronmikroskop, kan lösa objekt långt in i subnanometerskalan, dessa system fungerar under förhållanden som inte är idealiska för studier av biologiska prover. Upptäcka individuella fluorescerande etiketter fästa på biologiska molekyler av intresse med hjälp av laddningskopplade enheter (CCD) - arrayer av kiselchips som omvandlar inkommande ljus till en elektrisk laddning, har gett upplösningar så fina som fem nanometer. Dock, hittills har denna teknologi inte kunnat avbilda enstaka molekyler eller avstånd mellan ett par molekyler som är mycket mindre än 20 nanometer.
Chu och hans medförfattare kunde använda samma CCD-fluorescensteknologi för att lösa avstånd med subnanometerprecision och precision genom att korrigera ett trick av ljuset. De elektriska laddningarna i en CCD-array skapas när fotoner träffar kislet och lossnar elektroner, där laddningens styrka är proportionell mot intensiteten hos de infallande fotonerna. Dock, beroende på exakt var en foton träffar ytan på ett kiselchip, det kan vara en liten skillnad i hur fotonen absorberas och om den genererar en mätbar laddning. Denna olikformighet i svaret från CCD-kiselmatrisen på inkommande fotoner, vilket förmodligen är en artefakt av chiptillverkningsprocessen, resulterar i en suddighet av pixlar som gör det svårt att lösa två punkter som ligger inom några nanometer från varandra.
"Vi har utvecklat ett aktivt återkopplingssystem som tillåter oss att placera bilden av en enda fluorescerande molekyl var som helst på CCD-matrisen med subpixelprecision, vilket i sin tur gör det möjligt för oss att arbeta i ett område som är mindre än den typiska längdskalan med tre pixlar för CCD-icke-likformigheten, säger Pertsinidis, som är huvudförfattare på tidningen Nature. "Med detta återkopplingssystem plus användningen av ytterligare optiska strålar för att stabilisera mikroskopsystemet, vi kan skapa ett kalibrerat område på kiselmatrisen där felet på grund av olikformighet reduceras till 0,5 nanometer. Genom att placera de molekyler vi vill mäta i mitten av denna region kan vi få subnanometerupplösning med hjälp av ett konventionellt optiskt mikroskop som du kan hitta i vilket biologiskt labb som helst."
Chu säger att förmågan att flytta scenen i ett mikroskop små avstånd och beräkna bildens geometriska centrum (tyngdpunkten) gör det möjligt att inte bara mäta fotoresponsens olikformighet mellan pixlar, men också för att mäta olikformigheten inom varje enskild pixel.
"Att känna till denna olikformighet gör det möjligt för oss att göra korrigeringar mellan den skenbara positionen och den verkliga positionen för bildens tyngdpunkt, " säger Chu. "Eftersom denna olikformiga respons är inbyggd i CCD-matrisen och inte ändras från dag till dag, vårt aktiva återkopplingssystem låter oss ta bilder upprepade gånger på samma position i CCD-matrisen."
Pertsinidis fortsätter att arbeta med Chu och andra i gruppen för vidareutveckling och tillämpning av denna superupplösningsteknik. Förutom det humana RNA-polymeras II-systemet, han och gruppen använder det för att bestämma strukturen hos de epiteliala cadherinmolekylerna som är ansvariga för cell-till-cell-adhesionen som håller samman vävnad och andra biologiska material. Pertsinidis, Zhang, och ytterligare en postdoc i Chus forskargrupp, Sang Ryul Park, använder också denna teknik för att skapa 3D-mätningar av den molekylära organisationen inuti hjärnceller.
"Idén är att bestämma strukturen och dynamiken i vesikelfusionsprocessen som frigör neurotransmittormolekylerna som används av neuroner för att kommunicera med varandra, " säger Pertsinidis. "Just nu får vi in situ-mätningar med en upplösning på cirka 10 nanometer, men vi tror att vi kan driva denna upplösning till inom två nanometer."
I ett samarbete med Joe Gray, Berkeley Labs biträdande direktör för livsvetenskaper och en ledande cancerforskare, postdoktorer i Chus forskargrupp använder också superupplösningstekniken för att studera vidhäftningen av signalmolekyler på RAS-proteinet, som har kopplats till ett antal cancerformer, inklusive bröstet, bukspottkörteln, lunga och kolon. Denna forskning kan hjälpa till att förklara varför cancerterapier som fungerar bra på vissa patienter är ineffektiva på andra.
Förutom dess biologiska tillämpningar, Pertsinidis, Zhang och Chu i deras Natur papper säger att deras superupplösningsteknik också borde visa sig vara värdefull för att karakterisera och designa fotometriska precisionssystem inom atomfysik eller astronomi, och möjliggöra nya verktyg inom optisk litografi och nanometri.