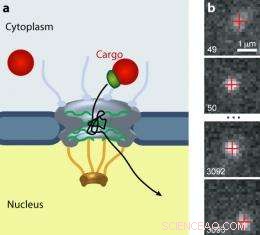
Kärnporkomplexet (NPC) spärrar trafiken av alla molekyler mellan cytoplasman och kärnan i eukaryota celler. (a) Större laster (röda) kräver en transportmottagare (grön) för att passera genom porten. (b) En quantum dot last rör sig genom en NPC. Bild:Alan Lowe
(PhysOrg.com) -- UC Berkeley-forskare Karsten Weis, Jan Liphardt, och kollegor har använt fluorescerande prober som kallas kvantprickar för att bestämma vilka molekyler som kommer in i kärnan via dess nanoporer och vilka som sparkas ut igen. Deras resultat kan hjälpa till att designa läkemedel som kan ta sig igenom porerna och rikta in sig på en cells DNA.
QB3-biofysiker har med oöverträffad upplösning spårat vägarna för laster som rör sig genom kärnporkomplexet (NPC), en selektiv bländare i nanoskala som styr åtkomsten till cellens kärna, och svarade på flera nyckelfrågor om dess funktion.
NPC, en stor proteinsamling formad som ett basketnät kantat av tentakler, är porten till cellkärnan, där genetisk information lagras. Varje cellkärna innehåller ungefär 2, 000 NPC, inbäddad i kärnvapenhöljet. NPC:n (som är cirka 50 nanometer bred) ansvarar för all transport in i och ut ur kärnan. För att förhindra att innehållet i resten av cellens inre blandas med kärnans innehåll, NPC skiljer mellan laster med stor precision.
Flera virus riktar sig mot NPC för att komma in i kärnan, och dysfunktionell transport mellan cytoplasman och kärnan har varit inblandad i flera sjukdomar inklusive cancer.
Forskare har konstruerat modeller för NPC, men hur denna kanal fungerar och uppnår sin selektivitet har förblivit ett mysterium. Det är känt att, för att ta sig igenom NPC, stora molekyler måste binda åtminstone ett fåtal receptorer som kallas "importiner"; huruvida bindning av fler importer påskyndar eller saktar en molekyls passage har varit oklart. Så, för, har den exakta punkten där ett bärarprotein som kallas "Ran" spelar en avgörande roll, ersätta en molekyl av GTP (ett cellulärt bränsle, en analog till den mer kända ATP) för en av BNP som den stora molekylen tar med sig när den kommer in i NPC.
Karsten Weis, en UC Berkeley professor i molekylär och cellbiologi, Jan Liphardt, en UC Berkeley professor i fysik, och kollegor genomförde avancerade bildexperiment som löste dessa problem. (Weis och Liphardt är medlemmar i QB3.) Forskningen publicerades den 1 september i tidskriften Natur , i en artikel där Berkeley post-doc Alan Lowe och doktorand Jake Siegel var gemensamma första författare.
Tidigare, forskare hade observerat rörelsen hos små molekyler (några nm i diameter), märkt med fluorescerande taggar, genom NPC. Men den snabba transiteringen och svaga signalen från dessa molekyler resulterade i glesa, otydlig data. Lowe, Siegel, et al. använde "kvantprickar", som är cirka 20 nm i diameter - och därmed långsammare än mindre molekyler - och mycket ljusare än konventionella fluoroforer. Forskarna täckte kvantprickarna med signaler som känns igen av importins. Med hjälp av en mikroskopisk teknik som gjorde att de kunde se en lägenhet, tunn visuell skiva genom levande celler, de såg hundratals enskilda prickar komma in, viftar runt i, kastas ut från, och i vissa fall erkänd genom, NPC:er. Forskarna spelade in videodata och spårade rörelsen av 849 kvantpunkter med nanometerprecision.
Kvantprickarnas spagettiliknande banor, överlagrade på varandra, avslöjade att partiklarna föll i tre klasser:"tidiga aborter, ” som kortvarigt spärrades in och sedan studsade ut; "sena aborter, ” som vandrade in och slingrade sig till den inre änden av poren innan de lämnade vägen de kom; och "framgångar, ” som följde ungefär samma vägar som de sena aborterna men beviljades inträde.
Från stigarnas oberäkneliga slingringar, forskarna drog slutsatsen att kvantprickarna verkligen spred sig slumpmässigt, snarare än att aktivt transporteras. Och att lägga till fler importins till prickarnas beläggning förkortade transporttiden, vilket tyder på att importins gör inkommande last mer löslig inom NPC snarare än att bindas till innerväggar.
Forskarna hittade ett särskilt intressant resultat när de undanhöll bärarproteinet Ran från experimentet. Utan Ran i mixen, kvantprickarna följde exakt samma intervall av banor som när Ran var närvarande, förutom att praktiskt taget ingen passerade NPC.
Med tanke på deras vägdata, författarna ritade en modell för hur NPC fungerar. Stor last fångas till en början av NPC:s filamentkant. Den stöter sedan på en förträngning, genom vilken den kan komma in i ett slags förkammare. Sedan, i vissa fall, Ran byter ut lastens BNP mot en GTP och den släpps in i kärnan. Endast det sista steget är oåterkalleligt.
"Det är en elegant studie, " säger Michael Rout, en professor i cellulär och strukturell biologi vid The Rockefeller University vars specialitet är NPC-transport. "Om vi så småningom förstår hur NPC fungerar på den mest subtila nivån, vi kanske skulle kunna bygga filter för att välja molekyler av intresse."
Verkligen, en av de viktigaste nya insikterna är att NPC:s selektivitet verkar vara resultatet av en kaskad av filter, var och en föredrar rätt last, snarare än bara ett mycket selektivt steg. Detta hjälper till att förklara varför vissa saker lätt kan komma in i kärnan och andra saker är uteslutna. Denna upptäckt kan ha några mycket praktiska kliniska implikationer, Liphardt och Weis säger. Det kan göra det möjligt för forskare att utveckla tekniker för att effektivt leverera stora konstgjorda laster, såsom läkemedelspolymerkonjugat och kontrastmedel, till kärnan, som innehåller genomet.