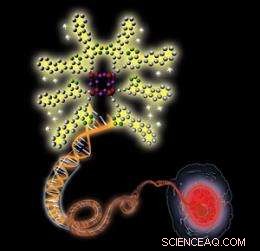
Schematisk illustration som visar en positivt laddad nanoprobe (övre vänstra) som binder till en negativt laddad dubbelsträngad DNA-molekyl (i mitten), resulterar i förbättrad fluorescens som möjliggör visualisering av en cellkärna (nere till höger). Upphovsman:2010 Wiley-VCH
Kärnor är komplexa, väldefinierade organeller som bär genetisk information som är kritisk för cellen. Visualisering av dessa organeller genom fluorescensavbildningstekniker lovar att avslöja mekanismerna som styr genetisk information och tillhandahålla sätt att förutsäga och behandla genetiska sjukdomar. I nära samarbete med Xinhai Zhang vid A*STAR Institute of Materials Research and Engineering, ett forskargrupp som leds av Bin Liu vid National University of Singapore har nu utvecklat en metod för att skapa ultraljud, mycket selektiva fluorescerande nanoprober för en cellkärnavbildningsteknik känd som två-foton exciterad fluorescens (TPEF) mikroskopi.
Forskare har föreslagit ett antal fluorescerande ämnen för att belysa kärnor i celler. Dock, ljusinducerade fenomen, såsom cellulär autofluorescens och allvarlig fotoskada, tenderar att försämra prestandan hos dessa sonder.
I TPEF -tekniken, varje nanoprobe producerar en fluorescerande signal genom att inte absorbera en utan två lågenergifoton av nära-infrarött ljus. Denna tvåfotonprocess minskar avsevärt effekterna av fotoskador och cellulär autofluorescens samtidigt som upplösningen förbättras, gör TPEF fördelaktigare än traditionell en-foton fluorescensmikroskopi.
"TPEF-avbildning är kraftfullare än en-foton-avbildning, särskilt för in vivo- och vävnadsavbildning där stark biologisk autofluorescens finns, Säger Zhang.
Istället för en traditionell steg-för-steg-syntes, forskarna antog en "bottom-up" -metod för att syntetisera nanoproberna för deras TPEF-system. Dessa nanoprober består av små oorganiska kisel -syreburar omgivna av korta positivt laddade polymerkedjor. Teamet skaffade burar och kedjor separat innan de sammanfogade dem, och syntesen lämpar sig bra för att producera TPEF-nanoprober med olika ljusemissionsfärger och bioigenkänningsmöjligheter.
Det lilla, stela burar underlättar införlivandet av sonderna i cellulära kärnor, medan de positivt laddade och ljuskänsliga kedjorna bidrar till vattenlöslighet och optiska egenskaper. Enligt Liu, dessa funktioner kombineras för att i slutändan producera TPEF-lämpliga tändprober.
Teamet upptäckte att fluorescensen hos sonderna blev väsentligt mer intensiv vid exponering för nukleinsyror, såsom dubbelsträngat DNA och RNA. Detta beror på att de positivt laddade sonderna binder tätt till de negativt laddade nukleinsyrorna genom attraktiva elektrostatiska interaktioner, öka mikroprofilernas hydrofobicitet hos sonderna och deras fluorescens. Vidare, sonderna färgade selektivt kärnorna i bröstcancer och friska celler med låg toxicitet.
Forskarna utökar för närvarande sin sondsamling till att inkludera andra intracellulära målapplikationer. De optimerar också sondarnas TPEF -prestanda ytterligare. ”Dessa nanoprober kan öppna nya sätt att förhöra biologiska system på ett kontrastrikt och säkert sätt, Säger Zhang.