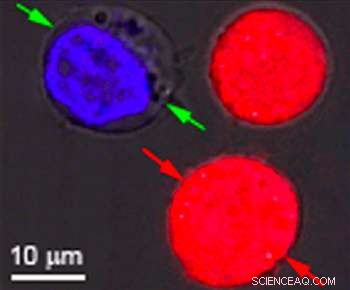
Identiska celler färgade rött och blått var målet för forskning vid Rice University för att visa effekten av plasmoniska nanobubblor. Bubblorna bildas runt uppvärmda guldnanopartiklar som riktar sig mot specifika celler, som cancerceller. När partiklarna är ihåliga, bubblor bildas som är tillräckligt stora för att döda cellen när de spricker. När partiklarna är fasta, bubblorna är mindre och kan slå ett tillfälligt hål i en cellvägg, låter droger eller annat material flöda in. Båda effekterna kan uppnås samtidigt med en enda laserpuls. Kredit:Plasmonic Nanobubble Lab/Rice University
(Phys.org) —Forskare vid Rice University har hittat ett sätt att döda några sjuka celler och behandla andra i samma prov samtidigt. Processen som aktiveras av en puls av laserljus lämnar närliggande friska celler orörda.
Den unika användningen av avstämbara plasmoniska nanobubblor som utvecklats i Dmitri Lapotkos rislab visar ett löfte om att ersätta flera svåra processer som nu används för att behandla cancerpatienter, bland andra, med en fasta, enkel, multifunktionell procedur.
Forskningen är i fokus i en artikel som publicerades online denna vecka av tidskriften American Chemical Society ACS Nano och utfördes på Rice av Lapotko, forskaren och huvudförfattaren Ekaterina Lukianova-Hleb och student Martin Matonga, med hjälp från Center for Cell and Gen Therapy vid Baylor College of Medicine (BCM), Texas Children's Hospital och University of Texas MD Anderson Cancer Center.
Plasmoniska nanobubblor som är 10, 000 gånger mindre än ett människohår orsakar små explosioner. Bubblorna bildas runt plasmoniska guldnanopartiklar som värms upp när de exciteras av en yttre energikälla - i detta fall, en kort laserpuls - och förånga ett tunt lager av vätska nära partikelns yta. Ångbubblan expanderar snabbt och kollapsar. Lapotko och hans kollegor hade redan funnit att plasmoniska nanobubblor dödar cancerceller genom att bokstavligen explodera dem utan att skada friska grannar, en process som visade mycket högre precision och selektivitet jämfört med dem som förmedlas av guld nanopartiklar ensam, han sa.
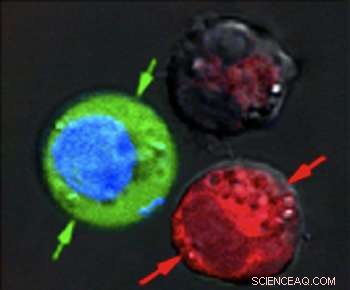
Efter laserpulsen, rödfärgade celler visar bevis på massiv skada från exploderande nanobubblor, medan blåfärgade celler förblev intakta, men med grönt fluorescerande färgämne indraget från utsidan. Kredit:Plasmonic Nanobubble Lab/Rice University
Det nya projektet tar den anmärkningsvärda förmågan några steg längre. En serie experiment visade att en enda laserpuls skapar stora plasmoniska nanobubblor runt ihåliga nanoskal, och dessa stora nanobubblor förstör selektivt oönskade celler. Samma laserpuls skapar mindre nanobubblor runt nanosfärer i massivt guld som slår en liten, tillfällig por i en cells vägg och skapar en inkommande nanojet som snabbt "injicerar" droger eller gener i de andra cellerna.
I sina experiment, Lapotko och hans team placerade 60 nanometer breda ihåliga nanoskal i modellcancerceller och färgade dem röda. I en separat sats, de lade in 60 nanometer breda nanosfärer i samma typ av celler och färgade dem blåa.
Efter att ha suspenderat cellerna tillsammans i ett grönt fluorescerande färgämne, de avfyrade en enda bred laserpuls mot det kombinerade provet, tvättade ut den gröna fläcken och kontrollerade cellerna under ett mikroskop. De röda blodkropparna med de ihåliga nanoskalven sprängdes isär av stora plasmoniska nanobubblor. De blå cellerna var intakta, men grönfärgad vätska från utsidan hade dragits in i cellerna där mindre plasmoniska nanobubblor runt de massiva nanopartiklarna i guld tillfälligt öppnade väggarna.
Eftersom allt detta händer på en bråkdel av en sekund, så många som 10 miljarder celler per minut skulle kunna bearbetas selektivt i ett genomflödessystem som det som utvecklas hos Rice, sa Lapotko, en fakultetsstipendiat i biokemi och cellbiologi samt i fysik och astronomi. Det har potential att främja cell- och genterapi och benmärgstransplantation, han sa.
De flesta sjukdomsbekämpande cell- och genterapier kräver "ex vivo"-utanför kroppen-behandling av humana celltransplantationer för att eliminera oönskade (som cancerceller) och för att genetiskt modifiera andra celler för att öka deras terapeutiska effektivitet, Sa Lapotko. "Nuvarande cellbearbetning är ofta långsam, dyrt och arbetskrävande och lider av höga cellförluster och dålig selektivitet. Helst bör både eliminering och transfektion (införandet av material i celler) vara mycket effektiv, selektiv, snabbt och säkert."
Plasmonisk nanobubbleteknik lovar "en metod att göra flera saker till en cellpopulation samtidigt, "sa Malcolm Brenner, professor i medicin och pediatri vid BCM och chef för BCM:s centrum för cell- och genterapi, som samarbetar med Rice -teamet. "Till exempel, om jag vill stoppa in något i en stamcell för att få det att bli en annan celltyp, och samtidigt döda omgivande celler som har potential att göra skada när de går tillbaka in i en patient - eller in i en annan patient - dessa mycket avstämbara plasmoniska nanobubblor har potential att göra det."
Det långsiktiga målet med ett samarbete mellan Rice, BCM, Texas Children's Hospital och MD Anderson ska förbättra resultatet för patienter med sjukdomar vars behandling kräver ex vivo cellbearbetning, Sa Lapotko.
Lapotko planerar att bygga en prototyp av tekniken med sikte på att testa med mänskliga celler inom en snar framtid. "Vi vill att detta ska vara en universell plattform för cell- och genterapi och för stamcellstransplantation, " han sa.