Kredit:ACS
(Phys.org) – Tyska forskare har utvecklat ett schema för beredning av nanopartiklar som erbjuder ett mycket mångsidigt system för riktad läkemedelsleverans direkt till olika typer av tumörceller.
Nanopartiklar har dimensioner på några miljondelar av en millimeter, och är alltså tillräckligt små för att erövra celler. Denna fastighet öppnar nya möjligheter i kampen mot cancer, som för närvarande är föremål för intensiv forskning. Ett LMU-team ledd av professor Christoph Bräuchle och professor Thomas Bein har nu utvecklat en mycket anpassningsbar plattform för produktion av nanopartiklar som kan användas som "nanofärjor" för riktad leverans av en rad läkemedelslaster till olika typer av cancerceller. Systemet beskrivs i en tidning som just har dykt upp i tidskriften Nanobokstäver .
Framför allt, det nya tillvägagångssättet gör det möjligt att tillverka specialdesignade nanopartiklar för särskilda uppgifter. "Partiklarna kan lätt laddas med en mängd olika kemiska medel och förses med etiketter som känns igen av specifika celltyper. de binder specifikt till vissa cancerceller och släpper sin last först efter att de tagits upp av cellen, säger Christoph Bräuchle som, som hans medarbetare Thomas Bein, är medlem i Nanosystems Initiative Munich (NIM), ett kluster av excellens. Systemet tillhandahåller således ett sätt att transportera anticancerläkemedel direkt och specifikt in i tumörceller.
Användningen av sådana nanopartiklar som transportfordon säkerställer att deras last endast utövar sin effekt inuti målcellerna. De föreningar som används i cancerkemoterapi är ofta mycket giftiga för många celltyper, så inriktning är avgörande om man vill minimera sidoskador på friska åskådarceller. Effektiv inriktning minskar således risken för allvarliga biverkningar avsevärt, samtidigt som den dos som krävs för ett meningsfullt kliniskt svar kan reduceras.
Intelligenta fraktsystem
Intelligenta nanopartiklar som kan rikta läkemedelsleveranser måste uppfylla ett antal kriterier. De måste ha hög lastkapacitet, och de behöver ett hölje som är kompatibelt med biologiska membran och kan presentera ligander som binder till specifika receptorer på målceller. När partiklarna har kommit in i cellen, de måste stimuleras av någon sorts signal för att frigöra sin kemikalielast. "Det är extremt svårt att designa en partikel som uppfyller alla dessa kriterier på en gång. Men vi har nu utvecklat ett system som, i princip, uppnår detta mål, och tillhandahåller en allmänt användbar plattform som är kompatibel med olika laster och målceller, säger Thomas Bein.
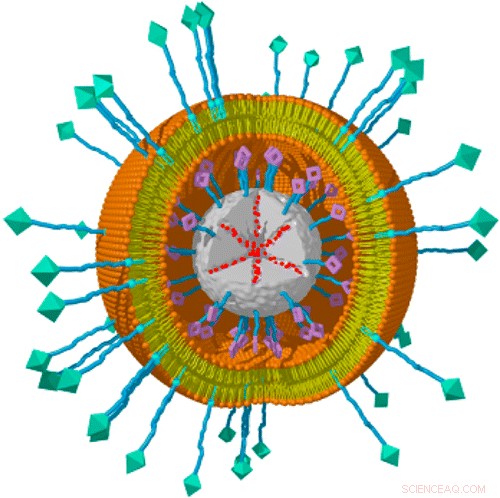
Systemet är baserat på nanopartiklar av mesoporös kiseldioxid, som säkert kan biologiskt nedbrytas och vars porer erbjuder en stor lagringsvolym för last. En fotosensibilisator är fäst på partikelytan, och droglasten lastas in i porerna. Varje partikel är sedan innesluten i ett lipiddubbelskikt liknande plasmamembranet i en typisk cell. En ligand som känns igen av receptorer som finns på specifika typer av cancerceller sätts sedan in i dubbelskiktet. I det nya verket, teamet testade ligander specifika för antingen hepatom eller livmoderhalscancerceller. Aktiveringen av fotosensibilisatorn med rött ljus leder till att lipidhöljet bryts upp och därför frigörs last.
"Att fotosensibilisatorn reagerar på rött snarare än det blå ljuset som använts i tidigare experiment, är ett viktigt framsteg. Rött ljus är mindre giftigt för celler och tränger djupare in i vävnader, säger Veronika Weiss, vars bidrag till studien kommer att utgöra en del av hennes doktorsavhandling. Hennes kollega Alexandra Schmidt tillägger:"En annan kritisk punkt är att fotosensibilisatorn är bunden direkt till drogbäraren, så att dess effekter är lokaliserade till omedelbar närhet av själva nanopartikeln, och har inte en destruktiv inverkan på större delar av cellens inre."
Den nya studien representerar ytterligare ett steg för ett mycket framgångsrikt långsiktigt partnerskap. 2010, samma samarbete utvecklade den grundläggande metoden för att trigga utsläpp av last från nanopartiklar efter att de tagits upp av målceller.