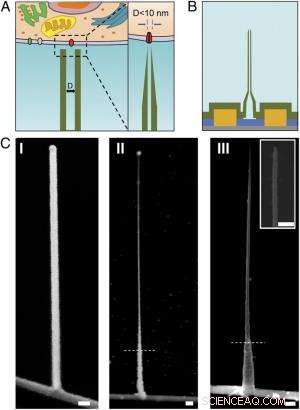
Schema och SEM-bilder av den ultrasmala BIT-FET. ( A ) Schematisk illustration av en intracellulär bioelektronisk sond. ( Vänster ) Allmänt schema för en sond för intracellulär elektrofysiologisk registrering. ( Höger ) En förstorad vy av spetsen på en bioelektronisk sond under 10 nm och dess relaterade storlek till en enstaka jonkanal. ( B ) Schematisk struktur av den ultrasmala BIT-FET. Grön, gul, blå, och grå färger representerar SiO 2 lager, metallkontakt, SiNW, och kiselnitridsubstrat, respektive. ( C ) SEM-bilder av den ultralilla BITFET vid olika tillverkningssteg. En GeNW-gren odlades först ovanpå SiNW ( jag ), följt av ett efterföljande H 2 O 2 etsning av den övre delen av GeNW för att krympa dess diameter ner till sub-10 nm regim ( II ). En sista vy av en ultraliten BIT-FET med nanorörs-ID ~8 nm, och SiO 2 väggtjocklek ~10 nm presenteras i ( III ). Insättning av III är närbilden av spetsen av den ultralilla SiO 2 nanorör. Vita streckade linjer in II och III ange den punkt under vilken GeNW och SiO 2 är skyddad av fotoresist under H 2 O 2 och BHF-etsning, respektive. Alla skalstaplar:100 nm. Kredit:Copyright © PNAS, doi:10.1073/pnas.1323389111
(Phys.org) — Miniatyriserade bioelektroniska sonder kan transformera biologi och medicin genom att tillåta mätning av intracellulära komponenter in vivo . Nyligen, forskare vid Harvard University och Peking University designade, tillverkade och demonstrerade bioelektroniska sonder så små som 5 nanometer med hjälp av en unik tredimensionell heterostruktur av nanotråd-nanorör. (En heterostruktur kombinerar flera heteroövergångar – gränssnitt mellan två lager eller regioner av olika kristallina halvledare – i en enda enhet.) Genom experimentella mätningar och numeriska simuleringar, forskarna visade att dessa enheter har tillräcklig tidsupplösning för att registrera de snabbaste elektriska signalerna i neuroner och andra celler, med integration i större chip-arrayer som potentiellt ger ultrahögupplöst kartläggning av aktivitet i neurala nätverk och andra biocellulära system.
Prof. Xiaojie Duan diskuterade uppsatsen att hon, Forskare Tian-Ming Fu, Prof. Charles M. Lieber och deras medförfattare publicerade i Proceedings of the National Academy of Sciences . Hon påpekar först att nanorörsonder och deras heterojunction med kisel nanotrådsfälteffekttransistorer (SiNW FET) blir mekaniskt mindre stabila när diametern minskar. "När nanoröret blir mindre och mindre, " Duan säger till Phys.org, "det blir lättare att bryta nanoröret vid kopplingsområdet med SiNW. I tillämpningen av att använda sonden för intracellulär bioelektronisk detektion, det kommer att finnas olika krafter, såsom kapillärkraften från vätskan, samt interaktion mellan sonden och cellmembranet. Dessa krafter kan bryta sonden om vi har en svag korsning mellan den och SiNW."
En annan fråga är att den elektriska känsligheten också minskar när nanorörsdiametern minskar, eftersom nanorörets inre diameter (ID) definierar den effektiva enhetens grindarea. "I inspelningen av intracellulär transmembranpotential med vår sond, Duan förklarar, "cytosol fyller nanoröret och fungerar som grindelektrod för den underliggande SiNW FET." Cytosol (även kallat intracellulär vätska eller cytoplasmatisk matris ) är vätskan som finns inuti celler, exklusive organeller och andra cytoplasmatiska komponenter. "Cytosolpotentialförändringen modulerar bärardensiteten hos SiNW FET, därigenom ändra dess konduktans, Duan fortsätter. "Så här fungerar vår sond för bioelektronikinspelning." Kontaktytan mellan cytosolen och SiNW – definierad av nanorörets innerdiameter – bestämmer effektiviteten i konduktansmoduleringen. Med andra ord, om nanorörets innerdiameter är för liten, SiNW FET-gateområdet kommer också att vara för litet.
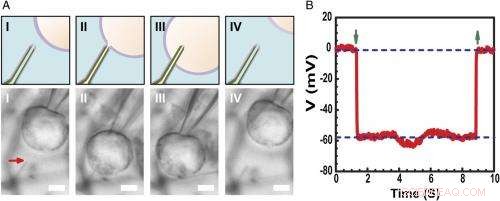
Intracellulär inspelning av vilomembranpotential. ( A ) Schema (Övre) och differentiell interferens kontrast optiska mikroskopibilder ( Lägre ) av en HL-1-cell manipulerad av en glasmikropipett för att närma sig ( jag ), Kontakt ( II ), penetrera ( III ), och dra tillbaka ( IV ) från en fosfolipidmodifierad ultraliten BITFET-sond. Den röda pilen indikerar positionen för den ultralilla nanorörsspetsen. Eftersom ren SiO 2 nanoröret är optiskt transparent, GeNW-mallen för denna enhet etsades inte för bildbehandling. Skalstång:2 μm. ( B ) Representativa elektriska inspelningar från en ultraliten BIT-FET-enhet med ~10 nm ID; I detta fall, GeNW etsades för att ge den ultralilla SiO 2 nanorör. Nedåt- och uppåtpekande gröna pilar markerar början på cellpenetration och tillbakadragande, respektive. De övre och nedre horisontella streckade linjerna indikerar de extracellulära och intracellulära potentialerna. Kvasistatiska vattenportmätningar gjorda före/efter cellmätningar visar <2% förändring i enhetens konduktans och känslighet. Kredit:Copyright © PNAS, doi:10.1073/pnas.1323389111
Forskarna presenterades också för det faktum att högfrekvent dynamisk respons kan försämras med minskande nanorörs innerdiameter på grund av ökande lösningsmotstånd i nanoröret. "När nanorörets inre diameter minskar, Duan förklarar, "motståndet hos lösningen inuti nanoröret kommer att öka, på grund av minskningen av lösningsledarens tvärsnitt." Dessutom, hastigheten med vilken den underliggande SiNW FET kan svara på en signal bestäms av produkten RC av kapacitansen och motståndet hos lösningsledaren inuti nanoröret – så om nanoröret blir mindre, motståndet blir större. Detta innebär att SiNW FET kommer att behöva mer tid för att svara – och om signalförändringen är för snabb, sonden kommer inte att kunna registrera det på ett tillförlitligt sätt. "Det är vad vi menar med "högfrekvent dynamisk respons kommer att försämras med minskande nanorörs inre diameter, Duan tillägger, "Dock, vi hittade det för vår sond, även om vi minskar nanorörets inre diameter till så liten som 5 nm, sonden kan fortfarande spela in en 3 kHz-signal troget – en bandbredd som är tillräcklig i de flesta fall för att spela in neurala och hjärtsignaler."
Forskarna konfronterades också med behovet av att använda aktiva halvledarnanowire fälteffekttransistordetektorer för att övervinna begränsningarna av sondstorleksminskning. "Ordet aktiv" jämförs med den "passiva" karaktären av inspelning med metallelektroder, " påpekar Duan. "För metallelektrodinspelning, en del av transmembranpotentialen V m will be dropped or lost at the electrode/electrolyte interface, so the signal recorded will be smaller than the real transmembrane potential." When the size of the metal electrode is reduced, the impedance value at the electrode/electrolyte will increase – and at some point, this impedance will get so large that the recorded signal will be obscured by noise. Dock, for the FET recording, the cytosol potential change is reflected by the semiconductor channel conductance change, which is independent of the probe/electrolyte interface impedance. "Since decrease in probe size will therefore inte affect the signal amplitude, " Duan adds, "using the FET to sense potential is a very effective way to overcome the limitations of probe-size reduction."
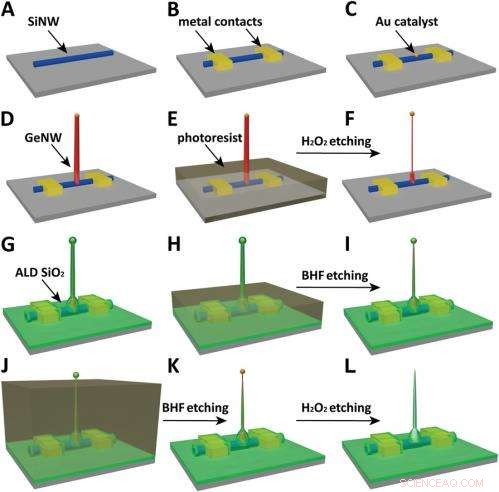
Schematics of the fabrication flow for the ultrasmall BIT-FET. ( A ) SiNWs (blue) are dispersed on substrate (solid gray). ( B ) S/D contacts are defined by EBL followed by thermal evaporation. ( C ) Au nanodots are defined on SiNWs between S/D using EBL and thermal evaporation. ( D ) GeNWs (red) are grown on top of the SiNWs through nanocluster-catalyzed CVD process. ( E ) A thin layer of photoresist (transparent gray) is spin coated on the chip to protect the lower GeNW part. ( F ) The resulting H 2 O 2 -etched GeNWs following photoresist liftoff. Only the GeNW above the photoresist in E is thinned by etching in H 2 O 2 . (G) SiO 2 is conformally deposited over the entire chip by ALD. ( H ) A thin layer of photoresist (transparent gray) is spin coated to protect the lower region of chip. ( jag ) The resulting BHF etched structures following liftoff. The region of SiO 2 above the photoresist layer in H is etched to ca.10-nm thickness. ( J ) Photoresist with thickness smaller than the GeNW heights is deposited. ( K ) The resulting structure following BHF etching of SiO2, which exposes the tips of the GeNWs. Isotopic BHF etching yields a small taper with thinner SiO 2 at the topmost part of the structure. (L) The GeNW is removed by H 2 O 2 etching to form an ultrasmall nanotube connected to the bottom SiNW FET. Copyright © PNAS, doi:10.1073/pnas.1323389111
Another critical challenge was synthetically integrating nanotubes and nanowires. "The nanotube is made of silicon oxide and the nanowire is made of silicon, " Du an notes. "For cell recording, the nanotube needs to be built vertically onto the nanowires – meaning that a three-dimensional heterostructure is needed." While the heterostructure could be fabricated in various ways, not all of them provided the required controllability at the probe scale. Därför, the researchers grew a germanium nanowire (GeNW) on top of the silicon nanowires, with the GeNW acting as a template for the nanotube. "Depositing SiO 2 on the GeNW/SiNW heterostructure, then selectively removing the core GeNW, resulted in the desired nanotube/SiNW structure, " notes Duan. "Using this method, the nanotube inner diameter can be controlled by the GeNW diameter, the outer diameter can be controlled by the SiO 2 thickness, and the nanotube length can be defined by the GeNW growth time. This gives us complete and easily implemented control over the probe's dimensions."
Till sist, the scientists had to investigate and model the bandwidth effect of phospholipid coatings, which are important for intracellular recording. "We use phospholipid coating to assist the nanotube probe to penetrate the cell membrane, " Duan notes. "Since the bandwidth of our probe is important for the probe to be able to record fast neural or cardiac signal, we need to make sure this phospholipid modification will not overly affect the bandwidth." Because the phospholipid layer will decrease the cross section of the solution conductor inside the nanotube, it impacts bandwidth in two ways by changing the capacitance and resistance of the solution inside the nanotube. (The phospholipid-modified probe bandwidth is easily determined by applying a fast artificial signal to the solution, and then recording how the conductance of the device changes over time. This provides the time the device needs to respond to this signal and thus the device's bandwidth.) "Therefore, " Duan explains, "if the nanotube is large, this thin phospholipid layer will not cause too much of a difference. Dock, for our probe, the sub-10 nm nanotube size is almost the same scale as the lipid layer – so we have to carefully examine how it affects probe bandwidth, both experimentally and theoretically."
The scientists addressed these myriad challenges in designing, tillverka, and demonstrating the probe with three key innovations. "The first is the use of FET as potential sensing element, which in principle enables us to overcome the size limit on the probe." Duan explains. "However, FETs have conventionally existed in a linear geometry with connections that preclude access to the inside of cells." The second innovation was the solution to this problem – namely, the design of a vertical SiO 2 nanotube on top of the nanoscale FET, which allowed them to introduce cytosol into the cell without having to insert the FET channel inside the cell, which would be more invasive. The third key is the design of a relatively large nanotube base with a much sharper nanotube tip, resulting in a sub-10 nm probe without sacrificing its mechanical strength and electrical sensitivity.
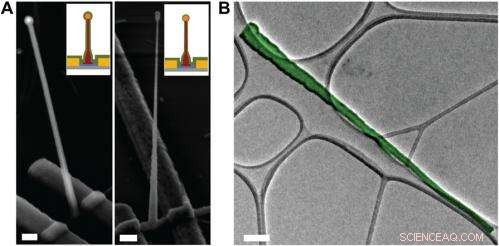
Electron microscopy characterization of the ultrasmall BIT-FET. ( A ) Representative SEM (Zeiss Ultra Plus field-emission SEM) images of intermediate fabrication steps of the ultrasmall BIT-FET. ( Vänster ) Device after 30-nm ALD coating of SiO 2 . ( Höger ) Device after first step of selective BHF etching of the upper80% portion of the SiO 2 to ca. 10 nm (Fig. S1 H och jag ). White dashed lines in jag och II indicate the point below which the SiO 2 is protected by photoresist during BHF etching. Scale bars:200 nm. ( B ) False-colored transmission electron microscopy (JEOL 2100 TEM) image of an ultrasmall nanotube. This tube was fabricated following the same procedure as described in SI Text , and deposited onto lacey carbon grids (Ted Pella) from ethanol suspension. It has a tip ID ∼7 nm and bottom ID ∼80 nm. False color is used here to distinguish the SiO 2 nanotube from background amorphous carbon. Scale bar:50 nm. Kredit:Copyright © PNAS, doi:10.1073/pnas.1323389111
An important aspect of the study was ensuring that the bioelectronic devices had sufficient time resolution to record the fastest electrical signals in neurons and other cells. "The signals in neural system are normally in the millisecond scale, " Duan points out. "That means that to reliably record these signals, the recording device needs to have a bandwidth measure in kilohertz." While the probe's bandwidth decreases with the decrease of nanotube diameter, the scientists found that even for probes with inner diameters as small as 5 nm, the bandwidth is still around 3 kHz (a time resolution ~ 0.3 ms) in physiological solution. "This means that our probes have sufficient time resolution to record the fastest electrical signals in neurons and other cells, " Duan adds.
Dessutom, Duan points out, the scientists found that measuring the cell transmembrane resting potential with these ultrasmall bioelectronic devices demonstrates the capability for intracellular electrophysiology studies. "When we measured the transmembrane resting potential of HL-1 cell with our new probes, we found that with the phospholipid modification, the nanotube can easily and reliably penetrate the cell membrane, allowing the FET to record the intracellular transmembrane potential at full amplitude." After retracting the nanotube from the cell, the recorded potential can immediately revert to the extracellular potential. "Reliable cell membrane penetration and stable recording of intracellular transmembrane potential prove the capability of our probes for intracellular electrophysiology studies, " notes Duan.
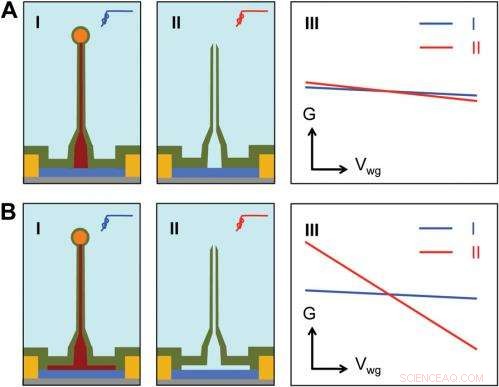
Sensitivity of different device structures. ( A , B ) Schematics of the ultrasmall BIT-FET without and with Ge overcoating on the SiNW, respektive. jag och II correspond to the BIT-FET devices before and after Ge core etching. III show schematically typical conductance ( G ) vs. water-gate (V wg ) measurements from these distinct structures. Kredit:Copyright © PNAS, doi:10.1073/pnas.1323389111
Moving forward, says Duan, the researchers' are planning to scale up their work to integrate the probes into high-density, large-scale array for large-scale mapping of neural activities; use the probes to record neural signals from small subcellular structures/organelles; and investigate other applications in which the probes will provide substantially greater spatial resolution and minimal invasiveness than other techniques.
Dessutom, the scientists might consider developing other innovations. "Till exempel, " Duan illustrates, "a major challenge in using our ultra-small probes for recording from small subcellular structures is to accurately position them with respect to the subcellular structures of interest. We're looking at either labeling our probe with fluorescence dye – or other biocompatible materials – to mark the nanotube at high resolution, or using specific targeting in which the probe's biochemical surface groups define the specific cell location being studied."
Duan sees other areas of research that might benefit from their study, Inklusive:
© 2014 Phys.org. Alla rättigheter förbehållna.