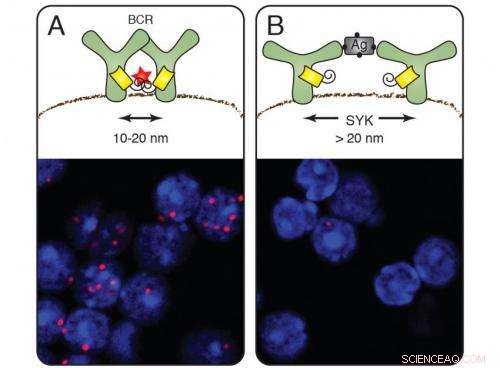
På vilande celler (A) bildar B-cellsantigenreceptorerna grupper och nanolinjalen avger röda signaler (cellfärgning nedan). Efter aktivering av B-cellerna av ett antigen försvinner den röda signalen (B). Kinaset Syk förmedlar öppningen av receptorn. Upphovsman:Michael Reth
Efter tio års ansträngning, Prof. Dr Michael Reth från Institute of Biology III vid University of Freiburg och Max Planck Institute of Immunobiology and Epigenetics har utvecklat en metod för att undersöka cellytans organisation i nanometerskala. Detta gör att han kan övervaka hur antigenreceptorn, vilka B-celler i immunsystemet använder för att känna igen främmande ämnen, ändras efter aktivering. Denna studie visar att receptorkomponenterna dissocierar från varandra – snarare än att monteras, som tidigare antagits. Omorganisation av receptorer på cellmembranet sker inom ett intervall av 10 till 40 nanometer. Under ett optiskt mikroskop, dock, det går bara att urskilja föremål som ligger minst 250 nanometer från varandra.
Genom att använda antikroppsfragment, så kallade Fabs, Reth, talare för cluster of excellence BIOSS Center for Biological Signaling Studies vid University of Freiburg, och hans team förbättrade upplösningen av den tidigare utvecklade proximity ligation assay (PLA) cirka 10 gånger.
Denna teknik tillåter detektering av molekyler endast när de är placerade i närheten av varandra. Med hjälp av den mer exakta Fab-PLA-metoden, forskarna kunde för första gången någonsin undersöka på en tio-nanometer skala hur receptorer fördelas på membranet och hur de omorganiseras. Fab-PLA-metoden är ett viktigt nytt instrument för BIOSS Nanoscale Explorer Progamme (BiNEP), en av forskningsinriktningarna vid Cluster of Excellence BIOSS Center for Biological Signaling Studies vid University of Freiburg.
När den appliceras på antigenreceptorerna, Fab-PLA-metoden avslöjade röda fluorescerande prickar på cellmembranet hos inaktiva B-celler:bevis på att antigenreceptorerna först uppträder på membranet i grupper, så kallade receptorkluster. Så snart B-cellerna upptäckte ett antigen och aktiverades, dock, prickarna försvann – receptorerna hade flyttat sig bort från varandra. Detta fynd stöder dissociationsmodellen för B-cellsaktivering som föreslogs av Michael Reth och Jianying Yang 2010.
Forskarna visade också hur dissociationen sker:De raderade i B-celler genen som kodar för signalmolekylen Syk, ett kinas som nära samarbetar med antigenreceptorn. På B -celler utan Syk fanns receptorklusterna kvar när de hade bundit antigenet. Syk är alltså den molekylära nyckeln som öppnar receptorklustret och initierar immunsvaret. För att klargöra de ytterligare detaljerna kring aktiveringen av B-celler, forskarna introducerade Syk och antigenreceptorkomponenterna i fruktflugaceller. De modifierade Syk och bestämde att klustret inte bryts upp förrän molekylen är bunden till den inre delen av antigenreceptorn.
Forskarna publicerade sina resultat i den nya tidskriften med öppen tillgång eLife . Studien inkluderade också en undersökning av organisationen i nanoskala av ytterligare receptorer på B-celler, inklusive CD19- eller CD20-molekylen. "Vi upptäckte att många receptorer är organiserade på membranet i specifika områden på nanoskalanivå, " förklarar Kathrin Kläsener, Doktorand och huvudförfattare till studien. Forskningen finansierades delvis av ett Advanced Grant för analys i nanoskala av proteinöar på lymfocyter från European Research Council (ERC), som Reth fick 2012.