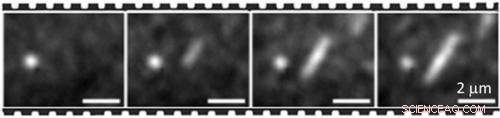
En förkortad time-lapse-sekvens av fluorescerande mikrofotografier som visar ett växande proteinfilament (mitten), med det ljusa runda aggregatet (vänster) som referenspunkt
Ebolavirus, Alzheimers amyloidfibriller, vävnadskollagenställningar och cellulärt cytoskelett är alla filamentösa strukturer som spontant sätts samman från individuella proteiner.
Många proteinfilament är väl studerade och finner redan användning inom regenerativ medicin, molekylär elektronik och diagnostik. Dock, själva processen för deras sammansättning - proteinfibrillogenes - förblir i stort sett oupptäckt.
En bättre förståelse av denna process genom direkt observation förväntas erbjuda nya tillämpningar inom biomedicin och nanoteknik samtidigt som effektiva lösningar för patogendetektion och molekylär terapi. Bildandet av proteinfilament är mycket dynamiskt och sker över tids- och längdskalor som kräver snabba mätningar med nano-till-mikrometer precision. Även om många metoder kan uppfylla dessa kriterier är varningen att mäta i vatten och i realtid. Utmaningen förvärras av behovet av att ha en homogen sammansättning som kännetecknas av enhetliga tillväxthastigheter av trådar av likformig storlek.
För att hantera denna utmaning, ett NPL-team utarbetade en arketypisk fibrillogenesmodell baserad på ett artificiellt protein vars sammansättning spelades in i realtid med hjälp av superupplösta mikroskopimetoder. Resultaten har publicerats i Nature Publishing Groups Vetenskapliga rapporter .
Angelo Bella, Higher Research Scientist i NPL:s Biotechnology Group förklarar:"Genom att kontinuerligt kunna avbilda sammansättningen från början till mognad har vi fastställt att proteinmonomerer rekryterar i båda ändarna av växande filament med enhetliga hastigheter på ett mycket samarbetsfullt sätt."
Studien ger en mätgrund för att studera olika makromolekylära sammansättningar i realtid och lovar konstruktion av skräddarsydda nano-till-mikroskala strukturer på plats.