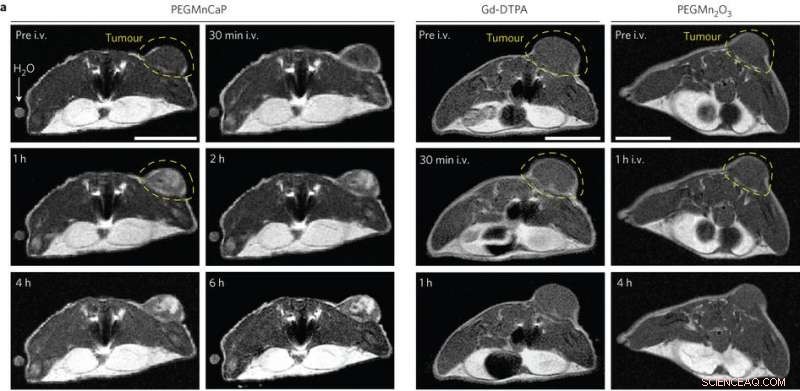
In vivo MR-bilder av subkutana C26-tumörbärande möss före och efter intravenös injektion (i.v.) av PEGMnCaP (vänster), Gd-DTPA (i mitten) och PEGMn2O3 (höger) mätt med 1 T MRI. Endast PEGMnCaP visade en selektiv och hög förstärkning av tumörkontrast. Skala, 1 cm. Kredit:(c) Peng Mi et al, Naturnanoteknik (2016). DOI:10.1038/nnano.2016.72
(Phys.org)-En ny typ av nanopartikelbaserat MRI-kontrastmedel visar selektivitet för tumörceller över icke-cancerceller, kan upptäcka hypoxi, och är tillräckligt känslig tillåter upptäckt av svårt att hitta cancerceller enligt en studie i Naturnanoteknik .
Forskare från University of Tokyo, Tokyo Institute of Technology, Kawasaki Institute of Industry Promotion, och Japan Agency for Quantum and Radiological Science and Technology har utvecklat ett kontrastmedel från kalciumfosfatbaserade nanopartiklar som frigör en manganjon till en sur miljö. Manganjonen binder sedan till proteiner som möjliggör en starkare kontrastsignal som varar längre än nuvarande kliniskt godkända alternativ. Dessa nanopartikelbaserade kontrastmedel är också funktionaliserade med ett poly (etylenglykol) skal som främjar vidhäftning till cancercellen.
Magnetisk resonansavbildning förlitar sig på excitation och efterföljande avslappning av protoner. I kliniska MR -studier, signalen bestäms av vätskeprotonernas avslappningstid i vatten. För att få en starkare signal, forskare kan använda kontrastmedel för att förkorta protonernas avslappningstid.
MR är icke-invasiv och innefattar inte strålning, gör det till ett säkert diagnostiskt verktyg. Dock, dess svaga signal gör det svårt att upptäcka tumörer. Det ideala kontrastmedlet skulle välja för maligna tumörer, vilket gör platsen och diagnosen mycket mer uppenbar.
Nanopartikelkontrastmedel har varit av intresse eftersom nanopartiklar kan funktionaliseras och, som i denna studie, kan innehålla olika metaller. Forskare har försökt att funktionalisera nanopartiklar med ligander som fäster vid kemiska faktorer på ytan av cancerceller. Dock, cancerceller tenderar att vara sammansatta heterogena, ledande några forskare att leta efter nanopartiklar som svarar på skillnader i pH eller redoxpotential jämfört med normala celler.
Peng Mi, Daisuke Kokuryo, Horacio Cabral, Hailiang Wu, Yasuko Terada, Tsuneo Saga, Ichio Aoki, Nobuhiro Nishiyama, och Kazunori Kataoka utvecklade ett kontrastmedel som består av Mn 2+ - dopade CaP -nanopartiklar med ett PEG -skal. De menade att med hjälp av CaP -nanopartiklar, som är kända för att vara pH -känsliga, skulle tillåta den riktade frisläppandet av Mn 2+ joner i tumörmikromiljön. Tumörmikromiljön tenderar att ha ett lägre pH än de normala regionerna för snabb cellmetabolism i en syreutarmad miljö. Manganjoner testades eftersom de är paramagnetiska, vilket ger ett bra kontrastmedel. De binder också till proteiner som skapar ett långsamt roterande mangan-proteinsystem som resulterar i skarp kontrastförbättring.
Studier med CaPMnPEG nanopartiklar visade att nanopartiklarna är stabila under fysiologiska förhållanden (pH 7,4) och endast 8% av Mn 2+ joner släpptes under dessa förhållanden. Under förhållanden som efterliknar tumörmikromiljön och intercellulär miljö, inom fyra timmar 36% av Mn 2+ joner släpptes vid pH 6,7, 71% vid pH 6,5, och över 90% vid pH 5.
Dessutom, tester med CaPMnPEG och humant serumalbumin (HSA) i ett surt medium visade signifikant signalförstärkning. Detta beror på proteinbindning av Mn 2+ Jon, vilket kraftigt ökade jonens molekylära relaxivitet.
Dessa resultat var lovande, så Peng Mi, et al. testade sedan om CaPMnPEG -kontrastmedlet fungerade i fasta tumörer. Eftersom Mn 2+ förblir begränsad i nanopartikelmatrisen vid fysiologiskt pH, CaPMnPEG visar en mycket lägre toxicitet jämfört med MnCl 2 . MR-studier visade en tumör-till-normal kontrast på 131% efter 30 minuter, vilket är mycket högre än Gd-DTPA, ett kliniskt godkänt kontrastmedel. Efter en timme, tumör-till-normal-förhållandet var 160% och förblev omkring 170% i flera timmar.
Tredimensionella MR-studier av solida tumörer visade att utan tillsats av CaPMnPEG, bara blodkärl var synliga. Dock, vid tillsats av CaPMnPEG, tumören var lätt urskiljbar. Dessutom, det finns bevis för att överskott av Mn 2+ lämnar plasma efter en timme. Kontrastsignalen förblev stark i flera timmar, vilket indikerar att proteinbindning snarare än Mn 2+ koncentration är viktigt för signalförbättring.
I synnerhet, det fanns ljusare kontrastförbättringsregioner på tumören. Ytterligare experiment visade att regioner med högre kontrast korrelerade till tumörhypoxi. Maligna tumörer tenderar att vara hypoxiska, vilket leder till laktatbildning. Detta resulterar i sänkning av pH. Andra tekniker för att upptäcka hypoxi tenderar att bara titta på ytan av målvävnaden eller, när det gäller PET, innebär strålning och dålig upplösning. Denna teknik är säkrare, icke-invasiv, och inte begränsat till yt tumörer.
Till sist, tester med metastatiska tumörer i levern (C26 tjocktarmscancerceller) visade att CaPMnPEG fungerar bra vid analys av fasta organ och är mycket känslig för att detektera millimeterstorlek mikrometastas. Till skillnad från andra kontrastmedel som används på kliniken, CaPMnPEG gav en kontrastsignal som varade i flera timmar efter injektion. Efter en timme, signalen förstärktes med 25% och efter två timmar, signalen förstärktes med 39%.
Denna forskning rapporterar utvecklingen och karakteriseringen av ett lovande nytt kontrastmedel som kan ge bättre tumördetektering och diagnos. Ytterligare studier kan innebära att testa detta kontrastmedel med andra sjukdomar som orsakar fysiologiska förändringar i pH samt in vivo övervakning av nya läkemedel.
© 2016 Phys.org