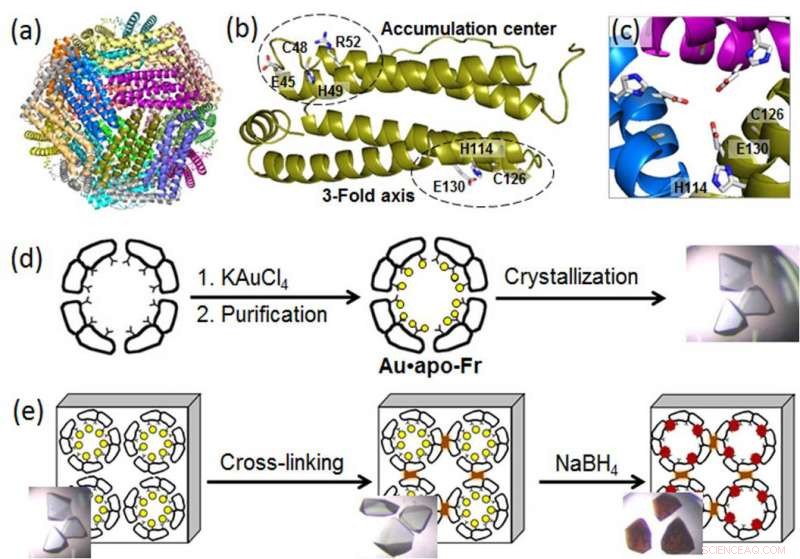
(a) 24-mer ferritinmolekylens struktur; (b) en ferritinmonomer med metallbindningsställena; (c) en symmetrisk 3-faldig axelkanal; (d) beredning och kristallisation av Au-innehållande ferritin; (e) tvärbindning av ferritinkristall och reduktion av aujoner (gula cirklar) till Au (0) atomer som bildar nanokluster (bruna partiklar). Upphovsman:Tokyo Institute of Technology
Forskare vid Tokyo Institute of Technology har använt högupplöst kristallografi för att avslöja mekanismen bakom proteinassisterad syntes av guldnanopartiklar, tillhandahålla en plattform för design av nanomaterial skräddarsydda för biomedicinsk tillämpning.
I levande organismer, fria metalljoner lagras och transporteras genom proteiner som samlats in i högordnade strukturer såsom proteinburar via en reaktion som kallas biomineralisering. Denna sofistikerade biologiska strategi har uppmärksammats av bioteknologer som spekulerar i att naturliga jonlagringsproteinburar kan användas för att odla metallnanopartiklar med önskade egenskaper.
Guldnanopartiklar (AuNP) är kända för sina utmärkta funktioner i katalys, biobildning, drogleverans, och terapi; därför, syntesen av AuP med kontrollerade storlekar och former är mycket viktig för deras tillämpning inom nanomedicin. I proteinställningar, AuNP bildas av en sekventiell process som involverar guldavsättning och agglomerering till små nanokluster som fungerar som kärnbildningscentrum för AuNP -tillväxt. Dock, den dynamiska mekanism som ligger till grund för bildandet av guldnanokluster i proteinmiljöer är fortfarande oklar.
För att avslöja molekylära processer bakom AuNP -tillväxt i proteinnanokor, en grupp biomolekylära ingenjörer vid Tokyo Institute of Technology, ledd av Takafumi Ueno, använde högupplöst kristallografi och analyserade bildandet av guldnanokluster i ferritin. Ett universellt intracellulärt järnlagringsprotein som produceras av nästan alla levande organismer, ferritin bildar en självmonterad 24-subenhet nanokammare med två specifika metallbindande platser:den 3-faldiga axelkanalen och ackumuleringscentret (Figur). Eftersom guldjoner har hög affinitet för svavel, forskarna modifierade ackumuleringscentret genom att införa ytterligare en svavelhaltig cysteinrest för att förbättra guldupptagningen i proteinburen. Sedan, de förstärkte Au-innehållande ferritinkristaller genom tvärbindning i glutaraldehyd (figur) för att bibehålla sin gitterstruktur. Dessa modifieringar möjliggjorde minskning av guldjoner i kristallerna och bestämning av bindningspositioner för guldjoner inuti ferritinburet genom högupplöst kristallografi.
I nästa steg, de immobiliserade guldjonerna reducerades till Au (0) -atomer med användning av ett reduktionsmedel (NaBH4). Som ett resultat, forskarna kunde observera att det reducerade guldet agglomererade till nanokluster som bildades i de 3-faldiga symmetriska kanalerna och i metallackumuleringscentra, vilket berodde på den gradvisa guldrörelsen och konformationsförändringar av omgivande aminosyror.
Resultaten som erhållits av professor Ueno och hans kollegor avslöjar mekanismen bakom bildandet av guldnanokluster som förväntas bli kärnkraftscentrum för efterföljande AuNP -tillväxt i den unika proteinmiljön, tillhandahålla en plattform för framtida undersökningar av biomineralisering och nanopartikelsyntes i biomolekylära byggnadsställningar.