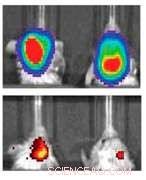
Den översta raden indikerar möss med glioblastom kontrollerade för tumörstorlek. Den nedre raden visar deras uttryck för MGMT, ett protein som gör tumörceller mer motståndskraftiga mot kemoterapi. Vänstern är en kontroll, medan den högra visar signifikant minskade nivåer av MGMT efter behandling med nanopartiklarna. Kredit:Northwestern University
Northwestern Medicine-forskare har utvecklat en ny testplattform för att bedöma, i realtid, effektiviteten av nanomaterial för att reglera genuttryck. Resultaten, publiceras i Proceedings of the National Academy of Sciences , kan hjälpa till att underlätta prekliniska undersökningar och optimera nanoterapeutika för cancer innan de når kliniska prövningar.
Timothy Sita, en sjunde året MD/PhD-student i Medical Scientist Training Program, var den första författaren till studien, som tittade på plattformen i djurmodeller.
"Detta är ett viktigt steg framåt för fältet, " sa chefsutredaren Alexander Stegh, PhD, biträdande professor i neurologi och medicin. "Den mycket grundliga optimeringen som vi ser inom konventionell läkemedelsutveckling hade saknats inom nanoteknikområdet, och vi kände mycket starkt för att ändra på detta. Systemet som vi utvecklade här tillåter oss verkligen att stödja dessa ansträngningar, och utvärdera våra nanopartiklar i de mest relevanta modellerna, i en in vivo-miljö."
Chad Mirkin, PhD, George B. Rathmann professor i kemi vid Weinberg College of Arts and Sciences och professor i medicin vid avdelningen för hematologi/onkologi, var också motsvarande författare till tidningen.
Forskarna demonstrerade konceptet medan de använde nanostrukturer som kallas sfäriska nukleinsyror (SNA) för att rikta in sig på en resistensfaktorgen i glioblastom, en aggressiv, obotlig typ av hjärntumör.
SNA, utvecklades först av Mirkin på Northwestern 1996, består av täta RNA-strängar packade runt en nanopartikelkärna. På grund av deras unika egenskaper, SNA:er kan både passera blod-hjärnbarriären och komma in i tumörceller, där de direkt kan rikta in sig på genaktivitet som uppmuntrar cancertillväxt.
Även om dessa konjugat är ett lovande verktyg i en tid präglad av precisionsmedicin, forskare saknade tidigare en kvantitativ metod för att bedöma hur SNA reglerade genaktivitet i levande organismer, vilket skulle ge nya insikter om hur man kan optimera terapierna.
"Vi har sett att dessa partiklar i princip kan rikta sig mot vilken cancergen som helst, men vi visste inte när de fungerade bäst eller vilka doseringsregimer vi skulle använda, " Sa Sita. "Som sådan, prekliniska prövningar var inte så framgångsrika som de kunde ha varit."
I den aktuella studien, forskarna visade att genom att använda en typ av icke-invasiv avbildning på mössen, de kunde mäta i realtid hur nanopartiklarna påverkade nivåerna av ett intratumoralt målprotein.
"Nu kan vi justera dessa partiklar - leka med nanopartikelns form, eller hur mycket RNA vi laddar på partikeln, till exempel – och sedan mycket snabbt bedöma om dessa förändringar är mer effektiva eller inte, Sita förklarade. "Det är en plattform för att hjälpa till att optimera läkemedlen i möss innan de går till mänskliga försök, och göra något som kommer att översättas bättre till kliniken."
Även om metoden kan vara generaliserbar för att undersöka nanoterapeutika för många typer av cancer, studien har också kliniska implikationer som är unika för glioblastom.
Forskarna utvecklade nanopartiklar för att slå ner O6-metylguanin-DNA-metyltransferas (MGMT) – ett protein som minskar effekten av kemoterapi – hos möss med glioblastom. Genom bildplattformen, de upptäckte att möss hade de lägsta nivåerna av proteinet mellan 24 och 48 timmar efter att de fått nanopartiklarna, föreslår den optimala tiden för att administrera kemoterapi.
"Vi visade en mycket signifikant minskning av tumörvolymen när vi kombinerade dessa partiklar med kemoterapin, " Sa Sita. "Genom att tysta den här genen som orsakar resistens mot kemoterapi, vi kan få ett mycket djupare svar. Det är den viktigaste kliniska vinkeln."