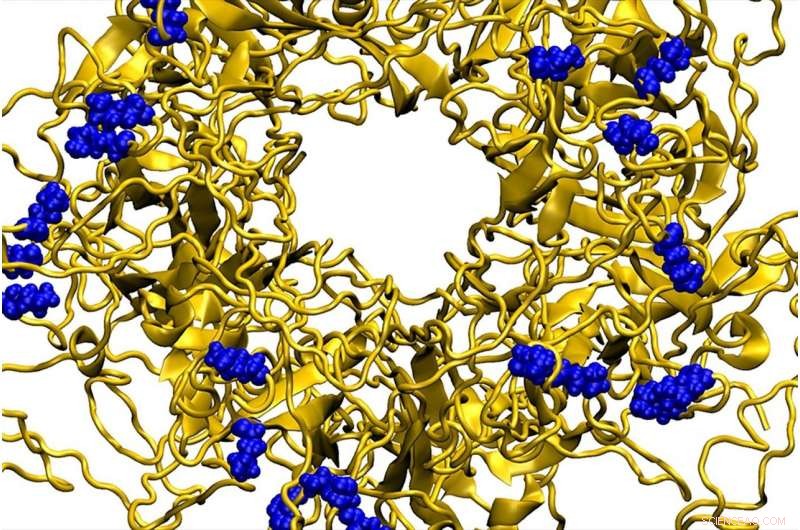
En molekylär dynamik modell som visar en nanopartikel som binder till det yttre höljet av det humana papillomviruset. Upphovsman:Petr Kral
Virusinfektioner dödar miljontals människor världen över varje år, men för närvarande tillgängliga antivirala läkemedel är begränsade genom att de mestadels verkar mot ett eller en liten handfull relaterade virus. Det finns några bredspektrumläkemedel som förhindrar virusinträde i friska celler, men de måste vanligtvis tas kontinuerligt för att förhindra infektion, och resistens genom viral mutation är en allvarlig risk.
Nu, en internationell grupp forskare inklusive UIC -professor i kemi Petr Kral, har utformat nya antivirala nanopartiklar som binder till en rad virus, inklusive herpes simplex -virus, mänskligt papillomvirus, respiratoriskt syncytialvirus och Dengue- och Lentivirus. Till skillnad från andra bredspektrumantiviraler, som helt enkelt hindrar virus från att infektera celler, de nya nanopartiklarna förstör virus.
Teamets resultat rapporteras i tidskriften Naturmaterial .
De nya nanopartiklarna efterliknar ett cellytprotein som kallas heparinsulfatproteoglykan (HSPG). En betydande del av virus, inklusive hiv, gå in och infektera friska celler genom att först binda till HSPG på cellytan. Befintliga läkemedel som efterliknar HSPG binder till viruset och hindrar det från att binda till celler, men bindningens styrka är relativt svag. Dessa läkemedel kan inte förstöra virus, och virusen kan återaktiveras när läkemedelskoncentrationen minskar.
Kral och hans kollegor, inklusive Lela Vukovic, biträdande professor i kemi vid University of Texas i El Paso och en författare på tidningen, försökte designa en ny antiviral nanopartikel baserad på HSPG, men en som skulle bindas tätare till viruspartiklar och förstöra dem samtidigt.
Tecknad film som visar en imaginär attack av nanopartiklar till ett virus som leder till dess förlust av integritet. Upphovsman:© SUNMIL/EPFL
För att specialdesigna de antivirala nanopartiklarna, Kral och Vukovics grupper arbetade hand i hand med experimenterande, virussexperter och biokemister från Schweiz, Italien, Frankrike och Tjeckien.
"Vi visste den allmänna sammansättningen av HSPG-bindande virala domäner som nanopartiklarna bör binda till, och strukturerna i nanopartiklarna, men vi förstod inte varför olika nanopartiklar beter sig så olika när det gäller både bindningsstyrka och förhindrande av virusinträde i celler, sa Kral.
Genom genomarbetade simuleringar Kral och kollegor hjälpte till att lösa dessa frågor och vägledde experimenterna med att anpassa nanopartikeldesignen så att de fungerade bättre.
Forskarna använde avancerade beräkningsmodelleringstekniker för att generera exakta strukturer för olika målvirus och nanopartiklar ner till platsen för varje atom. En djup förståelse av interaktionerna mellan enskilda grupper av atomer i virusen och nanopartiklarna gjorde det möjligt för forskarna att uppskatta styrkan och beständigheten av potentiella bindningar som kan bildas mellan de två enheterna, och hjälpte dem att förutsäga hur bindningen kan förändras över tid och så småningom förstöra viruset.
Lagets sista "utkast" till den antivirala nanopartikeln kan binda irreversibelt till en rad virus, och orsakade dödliga deformationer av virusen, men hade ingen effekt på friska vävnader eller celler. In vitro -experiment med nanopartiklar visade att de band irreversibelt till herpes simplex -viruset, mänskligt papillomvirus, syncytialt virus, Dengue -virus och Lentivirus.
"Vi kunde tillhandahålla den information som behövs till designteamet så att de kunde utveckla en prototyp av det vi hoppas kommer att vara ett mycket effektivt och säkert antiviralt bredspektrum som kan användas för att rädda liv, sa Kral.