
Mikrokapslar med skal av varierande tjocklek (röda) kan stabilt kapsla in last och släppa den vid exakt kalibrerad, lågt osmotiskt tryck, möjliggör säker leverans av droger och andra ämnen i människokroppen. Kredit:Wyss Institute vid Harvard University
Att knäcka ett ägg för att släppa äggulan kräver att man applicerar yttre kraft (som att bli smackad mot kanten på en skål) för att övervinna styrkan i äggskalet. Liknande, att leverera terapeutiska biomolekyler som innehåller mikrokapsel i människokroppen kräver att behållarna bryts efter att de har injicerats, så att lasten kan levereras på rätt plats vid rätt tidpunkt. Ett antal externa stimuli kan användas för att utlösa frisättningen av inkapslade molekyler, en av de enklaste är osmotiskt tryck, eftersom det helt enkelt kräver införande av vatten för att få mikrokapslarna att svälla och brista. Dock, för att skapa tillräckligt med inre tryck för att bryta kapselskalet, stora mängder av ett osmotiskt medel måste tillsättas till mikrokapseln för att locka till sig vattnet, och det resulterande höga sprängtrycket kan skada vävnader eller orsaka blodproppar.
En lösning på detta stötesten har nu utvecklats av forskare vid Harvards Wyss Institute for Biologically Inspired Engineering och John A. Paulson School of Engineering and Applied Sciences (SEAS), som tänkte ut ett sätt att skapa mikrokapslar med skal av ojämn tjocklek som gör att de kan spricka vid lägre osmotiska tryck, gör dem säkrare för användning i människokroppen. Forskningen är publicerad i Små .
"Våra skals svagaste del är 40 gånger tunnare än deras starkaste del, vilket gör det mycket lättare för dem att bryta och släppa sin last, "sa författaren Weixia Zhang, Ph.D., en postdoktor vid Wyss Institute och SEAS. "På baksidan, dessa mikrokapslar är extremt hållbara och läcker inte om de inte utsätts för förhöjt osmotiskt tryck, vilket gör dem mycket stabila och kan lagra innehållet under lång tid. "
För att tillverka sina inhomogena mikrokapslar, forskarna använde en glaskapillär mikrofluidisk anordning som använde en vatten-i-olja-i-vatten-metod för att kapsla in en vattenlösning innehållande sackaros, ett osmotiskt medel, i ett skal av monomerer suspenderade i olja. När monomererna utsätts för UV-ljus, de reagerar med varandra och tvärbinder till ett fast ämne, polymerskal runt sackaroslösningen. Genom att variera hastigheterna med vilka sackaroslösningen "last" och monomeroljans "skal" flyter genom enheten, teamet upptäckte att de kunde introducera variationer i tjockleken på skalen som bildades, skapa skeva kapslar med tjockare väggar på ena sidan och tunnare på den andra.
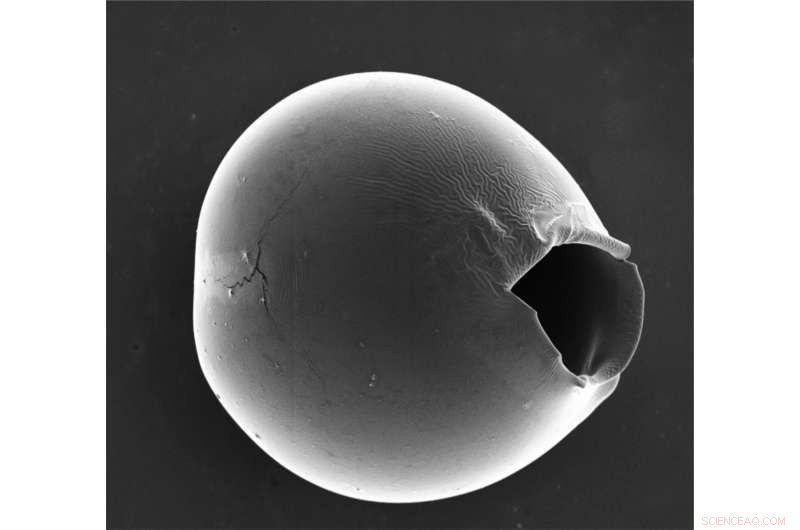
Mikrokapslarna spricker vid den tunnaste delen av skalet, lämnar en öppning som är tiotals mikrometer i storlek som gör att de flesta biomolekyler och läkemedel kan frigöras. Kredit:Wyss Institute vid Harvard University
Forskarna utsatte sedan sina mikrokapslar för osmotisk chock genom att tillsätta vatten, som diffunderade in i mikrokapslarna och fick dem att börja svälla vid den tunnaste delen av skalet. Efter cirka 20-30 minuter, det förtunnade skalet sprack, bildar en öppning som var tiotals mikrometer stor, som är tillräckligt stor för att de flesta biomolekyler och nanomaterial ska kunna släppas framgångsrikt. Att öka skillnaden mellan den tunnaste och den tjockaste delen av skalet ledde till ett större antal sprängda mikrokapslar, bekräftar att graden av inhomogenitet påverkade effektiviteten av lastfrisläppandet.
"Att kunna skapa mikrokapslar med hög grad av inhomogenitet genom att ändra skalets tjocklek under tillverkningsprocessen och att släppa ut lasten med mycket mindre osmotiskt tryck öppnar en ny applikation för kontrollerad frisättning, vilket är mycket viktigt för läkemedelsleverans inom medicin, såväl som andra områden, " sa medförfattaren Liangliang Qu, Ph.D., en postdoktor vid Wyss Institute och SEAS.
För att testa mikrokapslarnas hållbarhet, teamet kapslade in en fluorescerande polymer i dem och mätte förändringen i fluorescerande intensitet i deras kärnor över tiden. De observerade ingen förändring i intensitet under 30 dagar efter inkapsling, visar att mikrokapslarna behöll sin last utan att läcka. Vidare, polymerens storlek är mycket mindre än de flesta biomolekyler, såsom antikroppar och enzymer, vilket tyder på att skalen skulle kunna användas för att skydda och lagra biomolekyler eller läkemedel under längre tidsperioder.
Till sist, forskarna saminkapslade ett proteas (ett enzym som bryter ner proteiner) och sackaros inuti sina mikrokapslar i 37 dagar, applicerade sedan osmotisk chock för att utlösa frisläppandet av deras innehåll. Proteaset behöll 91% av sin ursprungliga aktivitet, vilket visar att denna lagringsmetod inte signifikant försämrade dess biologiska funktion.
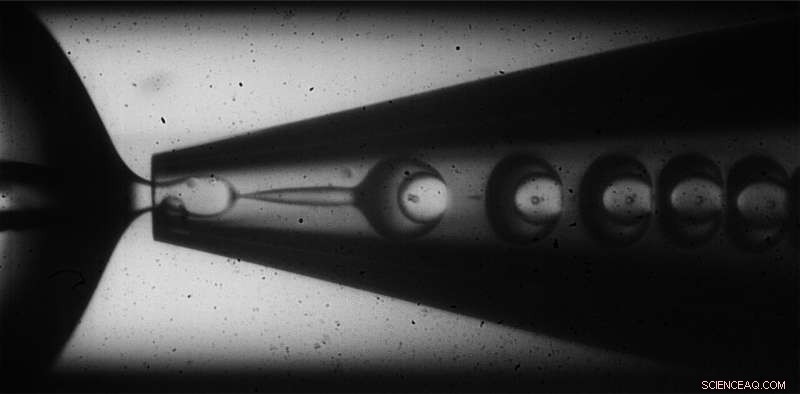
Mikrokapslarna skapas med hjälp av en olja-i-vatten-i-olja-teknik som uppnår inhomogen tjocklek genom att variera flödeshastigheterna för skalet och lastmaterialen. Kredit:Wyss Institute vid Harvard University
"Jämfört med andra bärare för kontrollerad frisättning, som celler, nanopartiklar, eller vesiklar, detta system är mycket mångsidigt, stabil, och anpassningsbar, gör det till ett attraktivt alternativ för att säkert och effektivt leverera läkemedel och andra biomolekyler för människors hälsa och andra tillämpningar, " sa motsvarande författare David Weitz, Ph.D., en Core Faculty Member vid Wyss Institute som också är Mallinckrodt-professor i fysik och tillämpad fysik vid SEAS.
Teamet fortsätter att utveckla sina mikrokapslar genom att optimera skalmaterialet för att ytterligare minska det osmotiska trycket som krävs för att spricka dem. De planerar att först tillämpa sin teknik på leverans av läkemedel, såsom terapeutiska antikroppar, med målet att kunna använda människokroppens höga vattenhalt för att fungera som bristningsutlösaren efter injektion.
"Det här projektet är ett bra exempel på hur enklare lösningar ofta kan vara bättre än komplicerade, eftersom den enda ingången som behövs för att spränga mikrokapslarna är mekaniskt tryck, snarare än komplex kemi eller molekylära växlar, " sa medförfattaren Donald Ingber, M.D., Ph.D., som är Wyss Institutes grundande chef, Judah Folkman, professor i vaskulärbiologi vid HMS och vaskulärbiologiprogrammet vid Boston Children's Hospital, och professor i bioteknik vid SEAS.