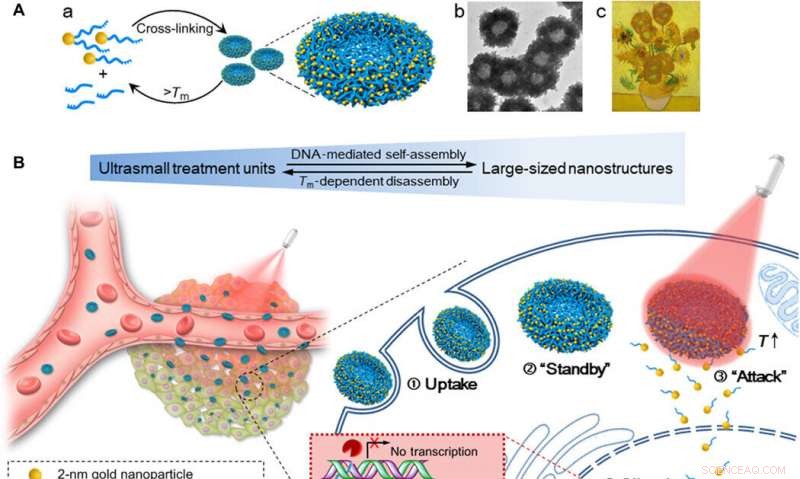
Schema med självmonterade guld-DNA nanosolrosor för ökad cellulär upptagsmängd, avstämbar genljuddämpande effekt, och kontrollerad tumörhämmande effekt genom NIR-bestrålning. (A) (a) Montering och demontering av den stora nanostrukturen (200 nm guld-DNA nanosolrosor) från/till ultrasmå nanopartiklar (2-nm Au-POY2T NP). (b) Representativ TEM-bild av nanosolrosorna. (c) Mästerverk:Solrosor (Vincent van Gogh, 1889). (B) Vänster:In vivo tumörretention och penetration av transformerbara nanosolrosor. Höger:Förbättrat cellulärt upptag och kontrollerad onkogen tystnadsprocess av nanosolrosorna in vitro. N Stora nanosolblommor togs upp av en MCF-7-cell. ② Nanosolrosorna standby i cellcytoplasman. ③ Vid NIR-bestrålning, stora guld-DNA nanostrukturer dissocierar och frigör små enheter (2-nm Au-POY2T NPs) för att attackera cellkärnan. ④ Ljuddämpningssekvensen POY2T kommer att binda till P2-promotorn för c-myc-onkogenen och nedreglera c-myc-uttrycket för MCF-7-celler, som kan styras (ON/OFF) och regleras (Låg/Medium/Hög) av NIR-bestrålningen. Kreditera: Vetenskapens framsteg , doi:10.1126/sciadv.aaw6264
Att utveckla ett effektivt leveranssystem för förbättrad och kontrollerad geninterferensbaserad terapi är en befintlig utmaning inom molekylärbiologi. Det framåtskridande området nanoteknik kan ge en effektiv, tvärvetenskaplig strategi för att underlätta nukleinsyratillförsel. I en ny rapport, Shuaidong Huo och kollegor i de tvärvetenskapliga avdelningarna för nanovetenskap, Interaktiva material, Kemi och polymerforskning i Kina, Tyskland och USA använde triplexbildande oligonukleotidsekvenser kopplade till dess komplementära sträng för att förmedla självmontering av ultrasmå guldnanopartiklar.
De resulterande solrosliknande nanostrukturerna visade stark nära infraröd (NIR) absorption och förmåga till fototermisk omvandling. När forskarna bestrålade strukturerna med NIR, de större nanostrukturerna demonterades för att generera ultrasmå nanopartiklar modifierade med c-Myc-onkogensekvensen för att direkt rikta cancercellskärnan. Huo et al. kontrollerad gentystnad genom att synergistiskt kontrollera tiden för förinkubering av celler med nanopartiklar tillsammans med nanostruktursjälvmontering (in vitro och in vivo) och tidsramen för NIR-bestrålning. Studien gav ett nytt paradigm för att konstruera effektiva och skräddarsydda nanobärare för tillämpningar av geninterferens och terapeutisk genleverans.
Genterapi har stor potential att behandla en mängd olika sjukdomar och komplikationer inklusive infertilitet, HIV och cancer. Framgångsrik genterapi för att lindra sjukdomssymtom beror på en effektiv genleveransvehikel eller vektor. Under processen, genbäraren måste korsa många biologiska barriärer och cellmembran medan endosomal infångning och nukleasbaserad nedbrytning undkommer. Jämfört med virusbaserade leveransstrategier, metoder för icke-viral genleverans står inför många utmaningar under processen att ladda och frisätta DNA/RNA, riktad leverans och intracellulärt upptag, inklusive inkompatibilitet i förhållande till immunsvar in vivo.
Kraftfulla ansträngningar inom nanoteknik pågår för att konstruera stabila och effektiva vehiklar för genöverföring till cancerceller. På grund av deras unika fysiokemiska egenskaper har ett antal nanomaterial dykt upp för genleverans. Bland dem, guldnanopartiklar (Au NP) med specifik storlek och ytegenskaper kan övervinna hinder in vivo för att bli ett av de mest studerade genbärarsystemen. Dock, dessa strategier har stött på en mängd brister och därför är det viktigt att etablera effektiva leveranssystem eller förbättrade och kontrollerade genterapier.
Självmontering och testning av solrosliknande nanostrukturer
I detta arbete, Huo et al. inspirerades av naturens förmåga att hybridisera DNA genom att konstruera DNA-medierad, självmonterade guld-DNA-nanostrukturer (ungefär 200 nm). Den solrosliknande designen visade stark NIR-absorption och fototermiska omvandlingsegenskaper. Vid NIR-bestrålning, strukturerna demonteras för att frigöra ultrasmå guldnanopartiklar (2 nm, Au NPs) med potential för tystning av onkogen, förbättrad cell- och kärnpermeabilitet och förbättrad transfektionseffektivitet. Forskarna kontrollerade synergistiskt interaktionerna mellan cell och nanomaterial baserat på tiden för förinkubation i labbet, följt av tid för cirkulation in vivo och tidslinjen för bestrålning. Experimenten underlättade ökat mobilupptag, avstämbar gen tystande effekt och kontrollerad tumörhämning. De transformerbara nanosolrosorna gav en utmärkt modell för att designa nanovehicles för läkemedelsleverans med stor potential inom biomedicin.
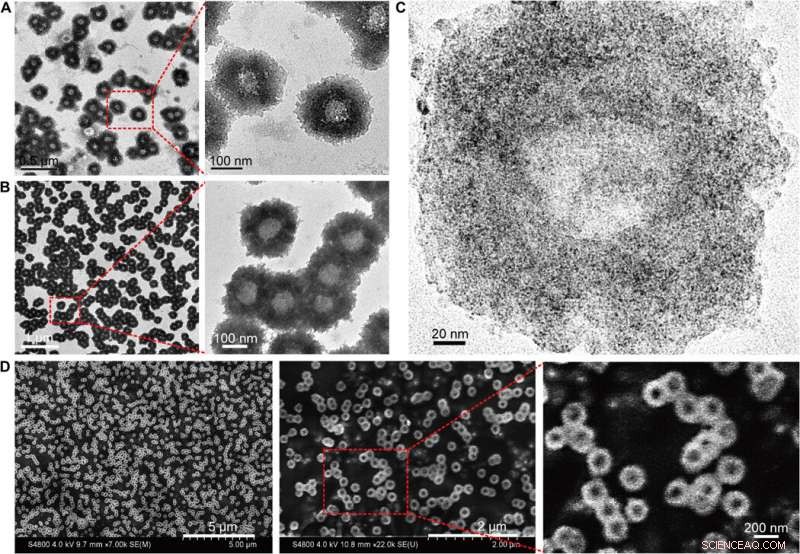
Morfologi karakterisering av de självmonterade nanostrukturerna (nanosolblommor). (A) TEM (200 kV) bilder av nanosolrosor med förstorade strukturella detaljer. (B) Bio-TEM (80 kV) bilder med förstorade polymer strukturella detaljer. (C) Högupplösta TEM (200 kV) bilder som visar fördelningen av ultrasmå NP på den självmonterade nanostrukturen. (D) SEM -bilder med förstorad ytopografi av nanosolblommorna. Kredit:Science Advances, doi:10.1126/sciadv.aaw6264
Huo et al. syntetiserade först de två nanometer Au NPs belagda med tiopronin och modifierade dem med tiol-oligonukleotider (SH-POY2T) med användning av en etablerad metod för ligandbyte. 23-nukleotid (nt) POY2T-oligonukleotiden band P2-promotorn för c-myc-onkogenen för att bilda en triplexstruktur och nedreglera onkogent c-myc-uttryck. Parallellt, de designade och syntetiserade en annan enkelsträngad sekvens känd som CA för att komplementärt hybridisera till svansen av POY2T-sekvensen och blockera dess bindning till c-myc-onkogenen. Vid färdigställandet, nanostrukturen självmonterad till solrosliknande strukturer. Teamet undersökte nanostrukturen (200 nm) med hjälp av transmissionselektronmikroskopi (TEM). Ytterligare avbildning avslöjade ytterligare detaljer om DNA-delarna i "solros"-strukturen. När materialforskarna använde svepelektronmikroskopi (SEM) för att validera TEM-resultaten, de observerade överensstämmelse mellan metoderna.
De undersökte UV-Vis-absorptionsspektra för ultraljud Au NP:er före DNA-medierad självmontering. De monodispergerade, individuella två-nanometer Au-POY2T NP visade stark absorption i NIR-regionen för att generera värme under NIR-bestrålning. Huo et al. krediterade den observerade starka NIR -absorbansen för nära interpartikelavstånd och ojämn spatial fördelning av enskilda NP:er inom den större nanostrukturen. De testade värmesvaret hos de självmonterade nanostrukturerna under NIR-bestrålning och noterade smältpunkten för de komplementära DNA-sekvenserna (POY2T och CA) till ungefär 41 grader C, dissocierar hälften av duplexstrukturen mellan komplementära DNA-sekvenser. Huo et al. valde 10 minuter som den optimala tiden för NIR -bestrålning i studien.
Studie av fototermiska egenskaper och demonteringsbeteende av de självmonterade nanostrukturerna. (A) Synliga absorptionsspektra av 2-nm kärnstorlek NP och 200-nm självmonterade nanostrukturer. a.u., absorbansenhet. (B) Temperaturrespons hos självmonterade nanostrukturer, vid NIR-bestrålning, dispergerat i vatten och cellodlingsmedium. Medelvärden ± SD, n =3. (C) Temperaturstegring av egenmonterade nanostrukturer, vid NIR-bestrålning, dispergerat i vatten och cellodlingsmedium. (D) Förändring av maximal absorbans (767 nm) av 2-nm kärnstorlek och 200-nm självmonterade nanostrukturer vid NIR-bestrålning. (E och F) TEM-observation av demonteringsbeteende hos 200 nm självmonterade nanostrukturer före (överst) och efter (botten) NIR-bestrålning (808 nm, 10 minuter). (G) Hydrodynamisk diameter av (a) monodispergerade 2-nm Au-POY2T NPs och storleksförändring av 200-nm nanosolrosor före (b) och efter (c och d) NIR-bestrålning under olika tidsperioder (3 och 10 min). Kredit:Science Advances, doi:10.1126/sciadv.aaw6264 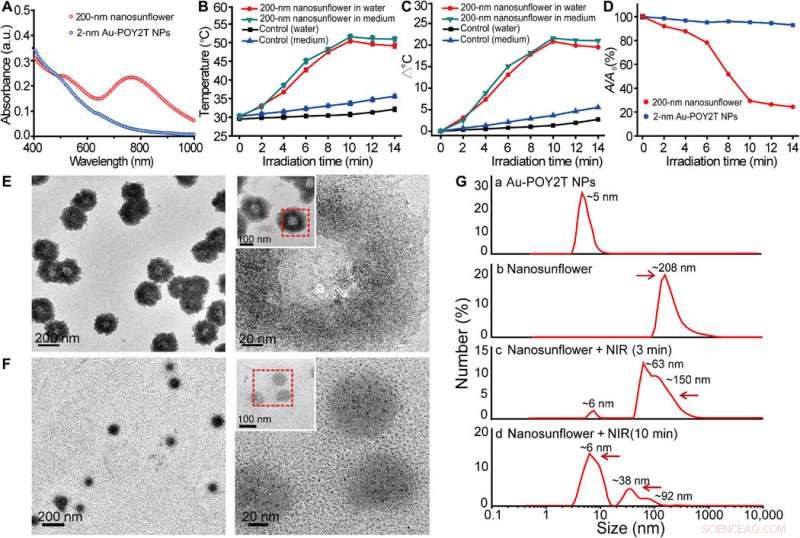
Forskarna antog att de självmonterade nanostrukturerna skulle krympa och demonteras till individuella ultrasmå Au-POY2T NP. Efter 10 minuters NIR-bestrålning, den maximala absorptionen (767 nm) av nanostrukturer minskade markant för att demontera solrosstrukturen. De följde experimenten före och efter NIR-bestrålning med TEM-observationer och använde partikelstorleksanalysatorer för att förstå demonteringsprocessen och storleksomvandlingen av nanostrukturerna upp till sex nanometer i storlek och bekräftade den optimala lämpligheten för 10-minuters tidslinjen.
Huo et al. applicerade NIR-bestrålning på MCF-7-celler behandlade med självmonterade guld-DNA-nanostrukturer och testade deras cellulära upptag in vitro som proof-of-concept. De bestämde den cellulära internaliseringen av Au-POY2T (2 nm) över olika inkubationstider och kvantifierade deras cellulära upptag med induktivt kopplad plasmamasspektroskopi (ICP-MS) och tidigare metoder. De noterade ökad internalisering efter sex timmars inkubation jämfört med 24-timmars inkubationstidslinjer. De observerade inte hämmare av endocytos för att påverka Au-POY2T NP-upptaget, föreslår involvering av en alternativ väg såsom membranfusion.
Förstå genljuddämpande beteende hos de självmonterade nanostrukturerna
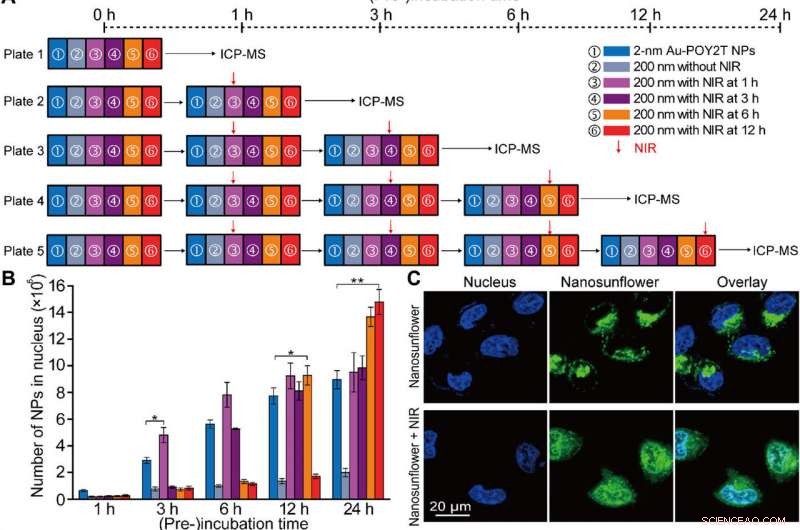
Kontrollerad kärnlokalisering och gentystnadsstudie in vitro av de självmonterade nanostrukturerna. (A) Schematisk in vitro-cellexperimentuppställning för den kontrollerade NP-kärnlokaliserings- och genregleringsstudien. (B) Antal 2-nm Au-POY2T NP lokaliserade i MCF-7 cellkärnan med behandling av ① individuella 2-nm Au-POY2T NP, ② 200-nm nanosolrosor, och 200-nm nanosolrosor med NIR-bestrålning (10 min) efter olika förinkubationstider (③ 1, ④ 3, ⑤ 6, och ⑥ 12 timmar). Medelvärden ± SD, n =3. Statistiska skillnader bestämdes med tvåsidigt Students t-test; *P <0,05 och ** P <0,01. (C) Konfokal observation av distributionen av fluorescein-isotiocyanat-märkta nanosolrosor (gröna) före (överst) och efter (botten) NIR-bestrålning i MCF-7-celler. Kärnan märktes med 4′, 6-diamidino-2-fenylindol (blå). (D) Bio-TEM-bild av lokaliseringen av stora nanosolblommor (överst, röd pil) i cytoplasman och distribution av frigjorda små NP:er (botten, blå pil) i cytoplasma och kärna efter NIR-bestrålning i MCF-7-celler. (E) Cytotoxicitetsutvärdering av MCF-7-celler med behandling av 200-nm nanosolrosor efter NIR-bestrålning (efter en period av förinkubationstid:1, 3, 6, och 12 timmar, respektive) jämfört med kontroll, 2-nm Au-TIOP NPs, POY2T-sekvens, CA -sekvens, 2-nm Au-POY2T NP, 200-nm nanosolrosor utan NIR-bestrålning, och endast NIR-exponering. Alla koncentrationer av behandlingar var vid eller lika med 1 μM i POY2T -sekvens och testades efter totalt 24 timmars inkubation. Medelvärden ± SD, n =3. Statistiska skillnader jämfördes med behandlingsgruppen av ① individuella 2-nm Au-POY2T NPs bestämda genom tvåsidigt Students t-test; *P <0,05 och **P <0,01. (F) C-myc mRNA-nivå bestäms av realtid PCR efter olika behandlingar som beskrivits ovan. Medelvärden ± SD, n =3. Statistiska skillnader bestämdes med tvåsidigt Students t-test; **P <0,01 och ***P <0,001. (G) C-myc-proteinnivåer bestämda med Western blot och (H) motsvarande kvantitativt histogram efter olika behandlingar som beskrivits ovan. GAPDH, glyceraldehydfosfatdehydrogenas. Kredit:Science Advances, doi:10.1126/sciadv.aaw6264
Efter förbättrad mobilupptagning av självmonterade nanostrukturer in vitro, forskargruppen undersökte fördelningen av nanopartiklar inom cellkärnorna med hjälp av "standby"- och "attack"-strategier efter NIR-utlösning. För detta, de extraherade cellkärnor efter inkubation, för ICP-MS-analys efter NIR-bestrålning över olika inkubationsperioder (en, tre, sex och 12 timmar). De noterade att pre-inkubationsperioden till stor del påverkar nanopartikelinternalisering inom cellkärnan, och forskarna reglerade Au-POY2T NPs i cellkärnan baserat på tidpunkten för förinkubation och NIR-bestrålning.
Huo et al. undersökte också NIR-bestrålningskontrollerade terapeutiska effekter av nanosolblommor med hjälp av cellviabilitetsprov; de observerade att onkogen tystnad ökade markant (80 procent) och dödade fler cancerceller. Forskargruppen kontrollerade den terapeutiska effekten effektivt genom att ändra tidslinjen för förinkubation och bestrålning effektivt. Resultaten stödde en överlägsen förmåga hos de transformerbara nanosolrosorna att tysta c-myc-onkogenen och onkoproteinet. Forskarna kontrollerade genavstängningsprocessen genom att justera tidslinjer före inkubation före NIR-bestrålning.
Kontroll av tumörtillväxthämning med hjälp av egenmonterade nanosolrosor
För att testa den kontrollerbara antitumöreffektiviteten hos nanosolrosor in vivo, forskarna undersökte först deras blodkompatibilitet för att bekräfta god blodbiokompatibilitet. Forskargruppen etablerade sedan tumörmodellen MCF-7 med hjälp av BALB/c nakna möss, tillät tumörvolymerna att nå 50 mm 3 och delade slumpmässigt upp djuren i nio grupper och behandlade dem med 1000 ul av olika POY2T-formuleringar. Efter varje injektion, de bestrålade djurgrupperna med NIR -lasrar i 10 minuter för att nå en lokal temperatur över 41 grader C.
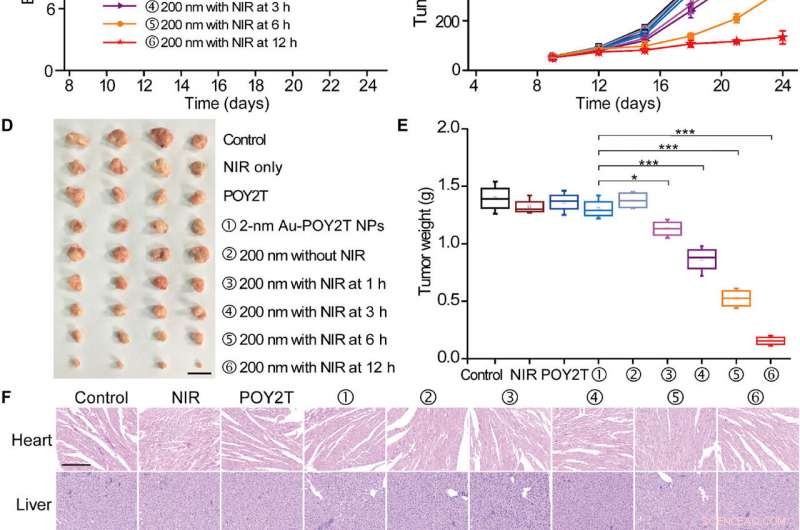
Kontrollerad tumörtillväxthämningsstudie av de självmonterade nanostrukturerna. (A) MCF-7-tumörmodellen BALB/c nakna möss etablerades på dag 0. Efter att tumörerna var klara, mössen delades slumpmässigt in i nio grupper och behandlades med 100 | il av olika formuleringar (motsvarande 10 | im i POY2T-sekvens; grupp ① med 2-nm Au-POY2T NP och grupper ②, ③, ④, ⑤, och ⑥ med 200 nm nanosolblommor) dag 9, 12, och 15. I grupper ③, ④, ⑤, och ⑥, tumörerna bestrålades med en NIR-laser i 10 minuter vid 1, 3, 6, och 12 timmar efter varje intravenös injektion. Salin, Endast NIR, och POY2T användes som kontrollgrupper. (B) kroppsvikter och (C) tumörvolymer mättes var tredje dag. Skalstång, 1 cm. Efter att mössen avlivats på dag 24, alla tumörer (D) isolerades och (E) viktades, respektive. Medelvärden ± SD, n =4. Statistiska skillnader bestämdes genom tvåsidiga studenters t-test; *P <0,05, **P <0,01, och ***P <0,001. (Foto:Ningqiang Gong, Nationellt centrum för nanovetenskap och teknik, Kina.) (F) Hematoxylin- och eosinfärgningsbilder av organ inklusive hjärtat, lever, mjälte, lunga, njure, och tumör efter olika behandlingar. Skala, 200 μm. Kredit:Science Advances, doi:10.1126/sciadv.aaw6264
Att notera, möss behandlade med den nanosolrosbehandlade gruppen och bestrålade efter 12 timmar visade de mest signifikanta antitumöreffekterna, vilket indikerar effektiv leverans av gen-tystnadsenheter till tumörstället. Efter 24 dagar, Huo et al. offrade djuren, isolerade tumörerna och vägde dem för att demonstrera nanosolrosbaserad NIR-kontrollerad tumörtillväxthämning in vivo. Baserat på histologiska studier, teamet visade att behandlingen signifikant minskade tumörtillväxt och inte påverkade morfologin hos andra organ. Resultaten verifierade den terapeutiska effektiviteten och bristen på biverkningar för nanosolblommor och NIR -terapi.
På det här sättet, Shuaidong Huo och kollegor designade, utvecklade och optimerade nanoagenter för effektiv antitumörterapi. De konstruerade självmonterade solrosliknande nanostrukturer för att fungera som multipartikelbärare laddade med många ultrasmå terapeutiska enheter. Vid NIR -bestrålning, nanostrukturerna dissocierade för att frigöra svärmar av små NP för att rikta in sig på cellkärnan. Hos tumörbärande möss, de stora solrosorna riktade sig passivt mot tumörstället följt av NIR-bestrålning för att transformera tumörens genetiska sammansättning och krympa den. Forskargruppen syftar till att förbättra transfektionseffektiviteten och tillhandahålla en ritning för kontrollerbar genavstängning på tumörställen med transformerbara geninterferensbärare för invecklade teranostiker på nivån för en enda cell.
© 2019 Science X Network