
Forskarna satte ihop tre distinkta DNA-nanostrukturer, inklusive en C-formad och två fatliknande strukturer, och visade genom Transmission Electron Microscopy att de var skyddade av sin kombinerade beläggnings- och tvärbindningsstrategi. Kredit:Wyss Institute vid Harvard University
Att slå cancer och en uppsjö av andra sjukdomar är inte bara beroende av att få tag i rätt läkemedel – det handlar också om att få dem till rätt ställen i kroppen, samtidigt som skador på friska vävnader begränsas till ett minimum. DNA-nanostrukturer som självmonterande DNA-origami som vikas till definierade former är lovande redskap för leverans av läkemedel och diagnostik, och olika vaccinationsstrategier. Detta beror på att de flexibelt kan funktionaliseras med små molekyler och proteinläkemedel, och immunogena antigener, samt funktioner som underlättar deras leverans till specifika målceller och vävnader. Dessutom, de är biokompatibla och biologiskt nedbrytbara.
Den stora potentialen hos DNA-nanostrukturer för olika biomedicinska tillämpningar, dock, hämmas fortfarande av deras begränsade stabilitet i kroppens vävnader och blod. William Shih, Ph.D. och hans team har nu tänkt ut en enkel, effektiv, och skalbar kemisk tvärbindningsmetod som kan ge DNA-nanostrukturer den stabilitet de behöver som leveransvehiklar för läkemedel och diagnostik. Deras studie publiceras i Journal of the American Chemical Society ( JACS ).
"För att hjälpa till att uppfylla det extraordinära löftet om DNA-nanostrukturer, vi utvecklade en brett användbar kemisk metod för att öka deras motståndskraft mot nedbrytning, sa William Shih, en Core Faculty-medlem vid Wyss Institute som leder projektet i Institutets Molecular Robotics Initiative. "Genom att modifiera DNA-nanostrukturer i två enkla steg, vi kan dramatiskt förbättra deras överlevnad, som tar bort en central flaskhals i översättningen av dessa nanoenheter till lösningar på en mängd olika medicinska problem."
DNA-origami är vanligtvis sammansatta av en lång DNA-sträng som viker sig till en definierad 3D-form på nanometerskalan med hjälp av flera korta stapelsträngar som förbinder olika delar av strukturen i rymden. DNA-ryggraden är starkt negativt laddad, vilket innebär att det kan vara problematiskt att föra olika delar av viktrådarna i närheten av varandra eftersom de naturligt stöter bort varandra, liknande de negativa ytorna på två magneter. För att övervinna dessa frånstötande krafter, forskare lägger vanligtvis till ett överskott av positivt laddade joner som magnesiumjoner (Mg 2 + ) till deras vikningsreaktioner som täcker ut DNA:s negativa laddningar.
Ofta, dock, den tillsatta Mg 2 + joner inte upprätthålls tillräckligt i 3-D DNA-origamistrukturer. Speciellt när det introduceras i kroppen, där normal Mg 2 + koncentrationerna är mycket lägre, Mg 2 + joner läcker från nanostrukturerna och får dem att sönderfalla. Dessutom, DNA-nanostrukturer är under konstant attack av DNA-nukleasenzymer som produceras naturligt i kroppen och bryter ner fria DNA-molekyler, dramatiskt minska deras stabilitet, som vanligtvis mäts som deras halveringstid. Det följer logiskt att genom att störa den strukturella integriteten hos DNA-nanostrukturer, dessa inre och yttre krafter begränsar också frisättningen av läkemedel eller tillgängligheten av diagnostiska reportermolekyler.
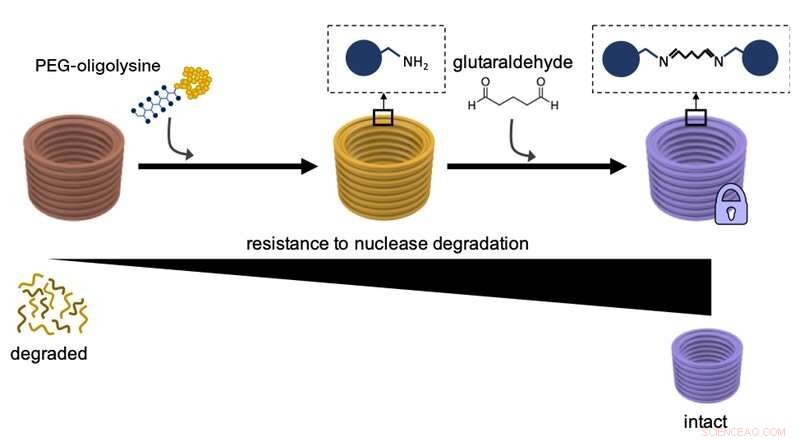
Detta diagram förklarar hur DNA-nanostrukturer först beläggs med PEG-oligolysiner, och sedan kemiskt tvärbindning av distinkta PEG-oligolysiner med glutaraldehyd som ett tvärbindningsmedel ökar deras motståndskraft mot nedbrytning av DNA-nukleasenzymer och övergripande stabilitet. Kredit:Wyss Institute vid Harvard University
I en tidigare studie, Shih och hans team hittade ett sätt att övervinna behovet av överdriven Mg 2 + koncentrationer för att stabilisera DNA-nanostrukturer. Genom att i huvudsak belägga ytorna på de stora DNA-strängarna med ett jämförelsevis litet diskret neutraliseringsmedel som bär flera positiva laddningar och är känt som PEG-oligolysin (eller PEGylerat oligolysin), de hade uppfunnit en metod som lätt kunde tillämpas för att stabilisera DNA-nanostrukturer i alla former och former på ett skalbart sätt. PEGylerat oligolysin består av korta kedjor av den positivt laddade aminosyran lysin - en av byggstenarna i proteiner - som är stadigt fästa till polyetylenglykol (PEG), en polymer molekyl som kan binda flera oligolysinkedjor. Forskarna tror att PEG fungerar som en "molekylär borste" för att förhindra aggregation av de neutraliserade nanopartiklarna.
I motsats till individuella Mg 2 + joner som, i teorin, var och en kan neutralisera endast två av de många negativa laddningar som exponeras av DNA-ryggraden med sina två positiva laddningar, PEGylerat oligolysin kan täcka flera negativa DNA-laddningar samtidigt, och bildar därmed ett stabilt "elektrostatiskt nät" som täcker ytan av DNA-nanostrukturer. Stabiliteten hos de belagda nanostrukturerna bibehölls till och med i levande celler och möss, visar att laget var på rätt väg.
"Med denna enkla strategi, vi kunde förlänga överlevnaden av DNA-nanostrukturer med cirka 400 gånger med halveringstider upp till 36 timmar i fysiologiska miljöer som också innehöll normala nukleasnivåer, " sa förstaförfattaren Frances Anastassacos, Ph.D., som vid tiden för studien var en doktorand som arbetade med Shih. "Dock, detta föll fortfarande under vad som behövs i vissa faktiska terapeutiska tillämpningar. PEGylerat oligolysin tenderade fortfarande att falla av DNA till viss grad."
I den JACS studie, teamet löste nu denna återstående del av "stabilitetsproblemet". "Vi knöt i huvudsak ytterligare knutar i det elektrostatiska nätet med hjälp av ett kemiskt tvärbindningsreagens känt som 'glutaraldehyd' som starkt binder distinkta PEGylerade oligolysiner på ytan av DNA-nanostrukturer, ", sa Anastassacos. "I närvaro av DNA-nukleasnivåer som vida överstiger de i människokroppen, deras överlevnad sträckte sig över 300 timmar. Den 400-faldiga ökningen av stabilitet som vi observerade med enbart PEGylerad oligolysin var förhöjd med ytterligare 250-faldigt, som träffar märket för kliniska tillämpningar."
Andra försök som lyckades stabilisera DNA-nanostrukturer med kemiska modifieringar förlitade sig mest på omdesignen av befintliga strukturer så att specifika platser inom deras 3-D-strukturer skulle bli tillgängliga för den utplacerade kemin. I kontrast, "vårt tillvägagångssätt kan utföras på vilken DNA-nanostruktur som helst, och dess lätthet och kostnadseffektivitet skulle avsevärt kunna stärka översättningen av många redan befintliga och nydesignade terapeutiska och diagnostiska strukturer, " sa Zhao Zhao, Ph.D., som är en av de första författare i studien och tidigare postdoktor i Shihs team.
I deras studie, Shih och hans team syftade till att maximera stabiliteten hos DNA-nanostrukturer. Forskarna, dock, tror att genom att ytterligare variera tvärbindningssteget, strukturernas halveringstid skulle kunna finjusteras till specifika tillämpningar som kräver att lastmolekyler blir tillgängliga vid olika tidpunkter och över olika tidsintervall. De har redan funnit att deras skyddsmetod inte stör bindningen av lastmolekyler till de modifierade strukturerna och upptagningen av strukturerna av odlade mänskliga celler. Nu, klinisk översättning kan påbörjas.