
Molekylär hiss. Kredit:Daria Sokol/MIPT
Biofysiker från Moscow Institute of Physics and Technology och University of Groningen i Nederländerna har visualiserat en nästan komplett transportcykel av däggdjursglutamattransportörhomologen från archaea. De bekräftade att transportmekanismen liknar en hiss:En "dörr" öppnas, joner och substratmolekyler kommer in, dörren stängs, och de färdas genom membranet. Förmodligen fungerar däggdjurstransportörerna på samma sätt, så denna upptäckt är potentiellt viktig för att utveckla nya behandlingar för schizofreni och andra psykiska sjukdomar som orsakas av att dessa transportörer inte fungerar. Forskningen publicerades i tidskriften Naturkommunikation .
Nervimpulser färdas genom människokroppen i form av kemiska signaler eller elektriska laddningar, som jonströmmar. Neuroner, cellerna i nervsystemet, kan generera och sprida elektriska signaler. En neuron består av en cellkropp med projektioner av två typer:flera dendriter och ett enda axon. Cellkroppen och dendriterna fungerar som en antenn som tar upp signaler från andra neuroner. Genom att summera och bearbeta alla insignaler, neuronen genererar sina egna impulser som sedan förs vidare till den intilliggande neuronen. Den elektriska impulsen i ett axon liknar den elektriska strömmen i ledningar, men det bärs av natrium- och kalciumjoner, snarare än elektroner. Som sagt, elektrisk signalöverföring är endast möjlig inom en neuron. Signalerna som överförs mellan neuroner är av kemisk natur och involverar speciella strukturer, kallas synapser.
Signalen i en synaps bärs vanligtvis av kemikalier som kallas neurotransmittorer. En neuron släpper ut neurotransmittorer i den synaptiska klyftan, och membranet hos den mottagande neuronen känner igen signalsubstansen via en dedikerad receptor.
Ett annat dolt men ändå viktigt steg i denna process är att neurotransmittormolekylerna måste avlägsnas från synaptisk klyfta för att möjliggöra nästa pulsöverföring. Annat, den mottagande neuronen kommer att överstimuleras. Neurotransmittorer rensas ut av dedikerade transportörer som pumpar dessa molekyler från den synaptiska klyftan tillbaka in i cellkroppen. Dessa transportörer finns antingen i neuronernas synapser eller i de så kallade gliacellerna, som ger stöd och skydd för neuroner (fig. 1).
Glutamat är den främsta excitatoriska signalsubstansen i den mänskliga hjärnan. När glutamat frisätts i den synaptiska klyftan, detta exciterar nästa neuron i sekvensen. Det mänskliga nervsystemet har också hämmande signalsubstanser, till exempel GABA (gamma-aminosmörsyra), som tar bort all potential i neuronen när den släpps.
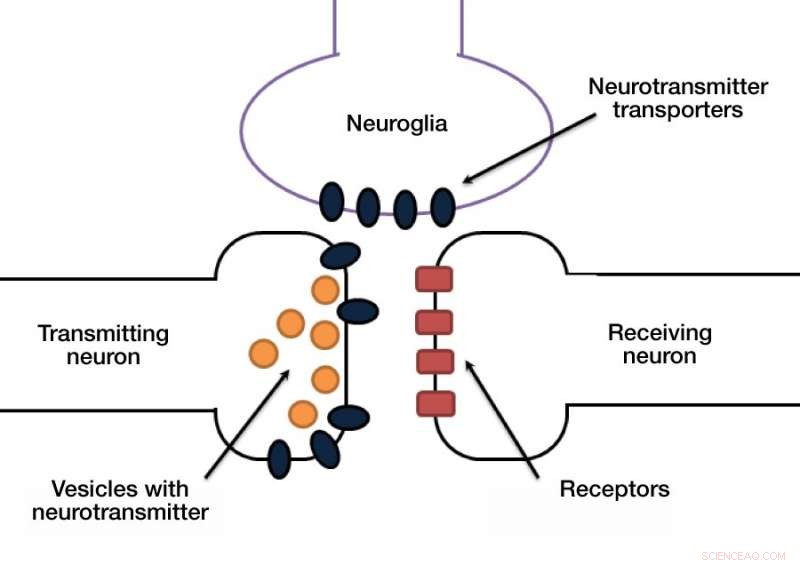
Figur 1. Synapse Credit:Anastasia Vlasova/MIPT
Glutamattransportören rensar ut glutamat från den synaptiska klyftan. Denna process är avgörande för den mänskliga hjärnans funktion. Hämningen av glutamatavlägsnande från klyftan är kopplad till många neurodegenerativa sjukdomar och psykiska störningar, inklusive schizofreni.
Ganska ofta kan vi lära oss mycket om någon genom att bara titta på deras släktingar. Detsamma gäller för evolutionärt liknande proteiner, kallas homologer. Gruppen ryska och holländska forskare har löst en konformationell ensemble av aspartattransportören från archaea, som är homolog med glutamattransportörerna hos människor.
Tills nyligen, Röntgenkristallografi var den huvudsakliga tekniken för att studera 3D-strukturerna hos proteiner. Den största utmaningen för den metoden är att kristallisera proteiner för att erhålla diffraktionsbilder från kristaller. Membranproteiner tenderar att inte lätt bilda väldiffraktionskristaller.
För att övervinna denna flaskhals, en annan teknik som kallas kryo-elektronmikroskopi kan användas. I cryo-EM bestrålas ett förglasat prov av en elektronstråle och de insamlade bilderna kombineras, vilket ger en tredimensionell rekonstruktion av proteinet. Den erhållna modellen analyseras och kan användas för att designa nya läkemedel.
Strukturen hos däggdjursglutamattransportörhomologen bestämdes med användning av ett kryoelektronmikroskop vid University of Groningen i Nederländerna. Dessa proteiner består av tre individuella molekyler, därför bildar de trimerer. Varje enskild protomer består av två delar:den orörliga delen fixerad i membranet och den mobila transportdomänen som liknar en hiss. Studien har avslöjat 15 protomerstrukturer (i fem trimerer), inklusive mellanliggande konformationer. Teamet bekräftade också oberoende rörelser av transportdomäner.
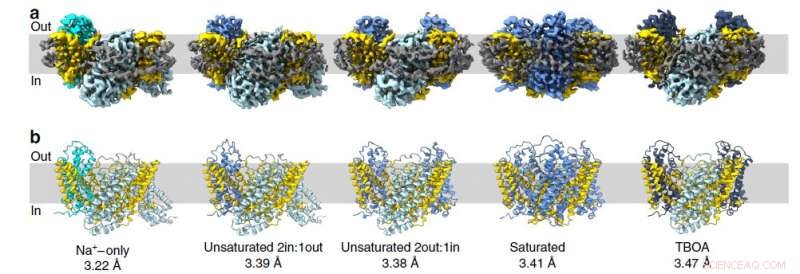
Figur 2. Strukturen av glutamattransportören från archaea i olika tillstånd. Varje bild representerar en ögonblicksbild där protomerer presenteras i följande tillstånd:inåt öppen (stålblå), intermediär-utåt ockluderad apo (cyan), intermediär-utåt ockluderad Asp (blåklintblå), utåtgående TBOA (mörkblå) Kredit:Valentina Arkhipova et al./Nature Communications
"Dessa strukturer hjälper oss att förklara hur dessa proteiner förhindrar natriumläckage, "chefen för MIPT-laboratoriet för strukturell elektronmikroskopi av biologiska system, Albert Guskov förklarade. "Precis som i en hiss, transportdomänen har en dörr, och så länge den är öppen, hissen kommer inte att röra sig. Men när natriumjonerna och substratet, i det här fallet, aspartatmolekylerna — går in i hissen, dörren stängs, och iväg går det. Så, om det bara finns natriumjoner närvarande, detta räcker inte för att stänga dörren."
"Detta gör transporten mycket effektiv, vilket är särskilt viktigt när det gäller mänskliga proteiner, eftersom det inte bara handlar om att äta upp aspartatet – som i archaea – utan om informationsöverföring mellan neuroner, ", tillade forskaren.
Laboratoriet för strukturell elektronmikroskopi av biologiska system, ledd av professor Guskov, håller på att etablera en modern vetenskaplig infrastruktur vid MIPT, möjliggör helcykelforskning om enpartikelkryo-EM i Ryssland. Under 2019, teamet lanserade en forskningsplattform baserad på kryoelektronmikroskopet FEI Polara G2 med ytterligare planer på att uppgradera det till det toppmoderna mikroskopet.
"Laboratoriets kompetens är mycket efterfrågad i det ryska forskarsamhället, och det växande internationella akademiska nätverket möjliggör tillgång till modern vetenskaplig infrastruktur. Sådan infrastruktur öppnar nya möjligheter för att studera biologins grundläggande frågor, såsom mekanismerna för funktioner hos jonkanaler och transportörer, interaktioner inom proteinkomplex, etc. Det hjälper oss också att hitta industriella partners som kan bedriva forskning för att tillämpa våra resultat inom läkemedelsdesign och på andra ställen inom medicin, " kommenterade professor Guskov.