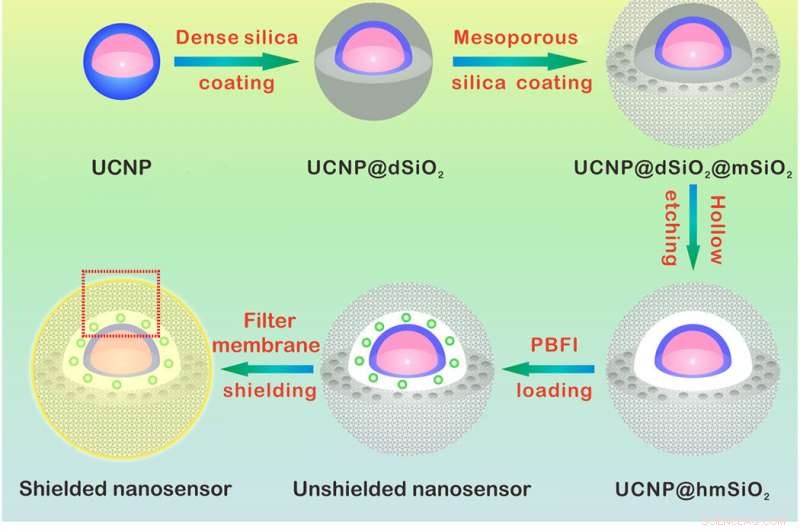
Design och avkänningsmekanism för K+ nanosensorn. (A) Schematisk illustration för syntesen av nanosensorn. NaYF4:Yb/Tm@NaYF4:Yb/Nd (UCNP)-kärnan syntetiserades och belades med ett tätt kiseldioxidskikt och ett successivt mesoporöst kiseldioxidskal. Etsning bort av det täta kiseldioxidskiktet bildar en ihålig hålighet som tillåter laddning av PBFI. Nanosensorn belades till sist med det K+-selektiva filtermembranet. (B) Schema som visar en förstorad bild av nanosensorn [från den röda prickade rutan i (A)] och dess K+-avkänningsmekanism. Filtermembranskiktet tillåter endast K+ att diffundera in i och ut ur nanosensorn, sålunda utesluter interferensen från andra katjoner. När den väl har diffunderat in i nanosensorn, K+ binder till PBFI omedelbart. Vid NIR-bestrålning, det uppkonverterade UV-ljuset från UCNP exciterar PBFI, leder till emission av K+-bundna PBFI. Kredit:Science Advances, doi:10.1126/sciadv.aax9757
Forskare har utvecklat ett antal kaliumjoner (K + ) sonder för att detektera fluktuerande K + koncentrationer under en mängd olika biologiska processer. Dock, sådana sonder är inte tillräckligt känsliga för att upptäcka fysiologiska fluktuationer hos levande djur och det är inte lätt att övervaka djupa vävnader med kortvågiga excitationer som är i bruk än så länge. I en ny rapport, Jianan Liu och ett team av forskare inom neurovetenskap, kemi, och molekylär ingenjörskonst i Kina, beskriva en mycket känslig och selektiv nanosensor för nära infraröd (NIR) K + jonavbildning i levande celler och djur. Teamet konstruerade nanosensorn genom att kapsla in uppkonverteringsnanopartiklar (UCNP) och en kommersiell kaliumjonindikator i den ihåliga håligheten hos mesoporösa kiseldioxidnanopartiklar och belagda dem med en K + selektivt filtermembran. Membranet adsorberade K + från mediet och filtrerade bort eventuella störande katjoner. I sin verkningsmekanism, UCNPs omvandlade NIR till ultraviolett (UV) ljus för att excitera kaliumjonindikatorn och detektera fluktuerande kaliumjonkoncentrationer i odlade celler och i djurmodeller av sjukdomar inklusive möss och zebrafisklarver. Resultaten publiceras nu på Vetenskapens framsteg .
Det vanligaste intracellulära katjonkaliumet (K + ) är extremt avgörande i en mängd olika biologiska processer inklusive neural transmission, hjärtslag, muskelsammandragning och njurfunktion. Variationer i det intracellulära eller extracellulära K + koncentration (här hänvisad till som [K + ]) föreslår onormala fysiologiska funktioner inklusive hjärtdysfunktion, cancer, och diabetes. Som ett resultat, forskare är angelägna om att utveckla effektiva strategier för att övervaka dynamiken hos [K + ] fluktuationer, speciellt med direkt optisk avbildning.
De flesta befintliga sonder är inte känsliga för K + detektion under fysiologiska förhållanden och kan inte skilja fluktuationer mellan [K + ] och den medföljande natriumjonen ([Na + ]) under transmembrantransport i Na + /K + pumps. Medan fluorescenslivstidsavbildning kan särskilja K + och Na + i vattenlösning, Metoden kräver specialiserade instrument. De flesta K + sensorer aktiveras också med ljus med kort våglängd inklusive ultraviolett (UV) eller synligt ljus – vilket leder till betydande spridning och begränsat penetrationsdjup vid undersökning av levande vävnader. I kontrast, den föreslagna nära-infraröda (NIR) avbildningstekniken kommer att erbjuda unika fördelar under djupvävnadsavbildning som ett rimligt alternativ.
Strukturell karakterisering av K+ nanosensorn. (A till C) Ringformade mörkfältsbilder i hög vinkel av UCNP@dSiO2 (A), UCNP@dSiO2@mSiO2 (B), och UCNP@hmSi02 (C). (D) Svepelektronmikroskopi (SEM) bild av den skärmade nanosensorn. (E) SEM-bild av den avskärmade nanosensorn nedsänkt i en vattenlösning innehållande 150 mM Na+, 150 mM K+, 2 mM Ca2+, 2 mM Mg2+, 50 μM Fe2+, 2 mM Zn2+, 50 μM Mn2+, och 50 μM Cu2+. (F) EDS elementarlinjeavsökningsprofiler längs den vita linjen i (E) avslöjar att endast K+-signaler finns i mesoporerna och ihåliga håligheterna i de avskärmade nanosensorerna. Kredit:Science Advances, doi:10.1126/sciadv.aax9757 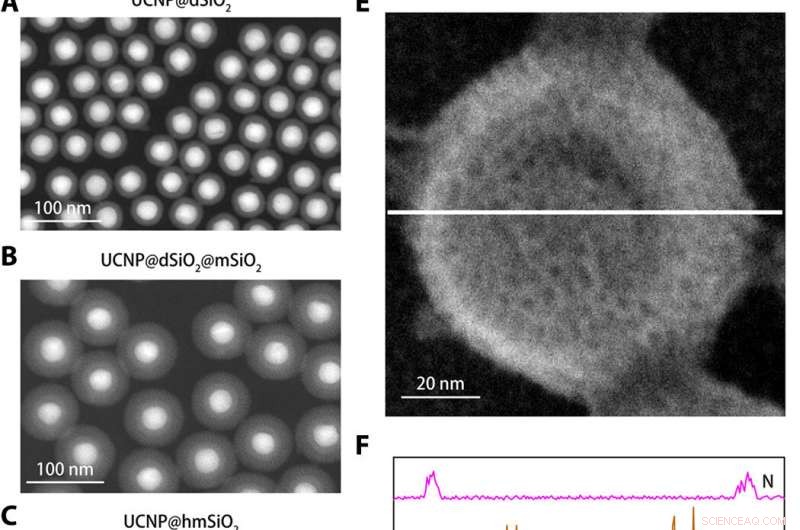
För att konstruera nanosensorn, Liu et al. inkapslade uppkonverteringsnanopartiklar (UCNP) och en kommersiell K + indikator – kaliumbindande bensofuranisoftalat (PBFI) in i kärnan av mesoporösa kiselnanopartiklar (MSN). UCNP:erna kunde omvandla NIR-ljus till UV-ljus och excitera acceptorn för K + indikator genom luminiscensresonansenergiöverföring. De skyddade den yttre ytan av silikananopartiklar med ett tunt lager av K + selektivt filtermembran med mikroporer skapade av karbonylsyre för specificitet. Upplägget gynnade den fria överföringen av K + genom membranporen, samtidigt som andra biologiskt relevanta katjoner förhindras från att diffundera igenom. Tekniken gjorde det möjligt för dem att upptäcka små fluktuationer i [K + ] i lösningen. Teamet använde transmissionselektronmikroskopi (TEM) för att observera den välkontrollerade strukturen och utseendet på nanopartiklarna under varje steg av nanosensorkonstruktionen. Dynamisk ljusspridning bekräftade närvaron av ett filtermembran på ytan av den avskärmade nanosensorn.
Avbildning av K+-utflöde i HEK 293-celler. (A) Schema som visar detektion av K+-utflöde av en streptavidinkonjugerad nanosensor, som är bunden till en biotinmodifierad cell. (B) Konfokalmikroskopibilder som visar fluorescensen (vid 400 till 500 nm och 500 till 600 nm) av nanosensormärkta HEK 293-celler vid olika tidpunkter efter behandling med K+ effluxstimulatorn (en blandning av 5 μM nigericin, 5 μM bumetanid, och 10 μM ouabain). (C) Tidsförlopp för nanosensorfluorescensvariationer och beräknat tidsberoende av K+ effluxhastighet efter behandling med K+ effluxstimulator. (D) Tidsberoende fluorescensfluktuationer av skärmade nanosensormärkta HEK 293-celler efter behandlingar med olika koncentrationer (20, 40, 60, 80, och 100 %) av K+ effluxstimulator. Resultat från fem oberoende experiment sammanfattades som medelvärde ± SEM i (C) och (D). Kredit:Science Advances, doi:10.1126/sciadv.aax9757 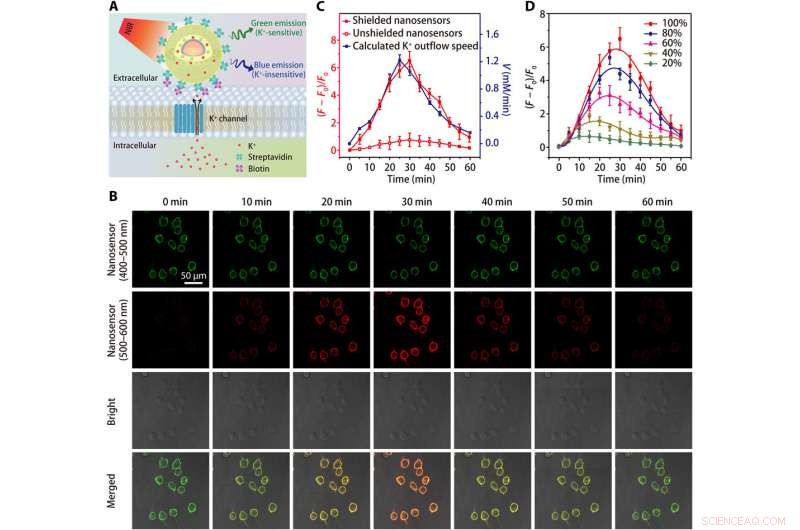
Teamet testade den ökade känsligheten hos den avskärmade nanosensorn i ett fysiologiskt område (0 till 150 mM) och visade en 12-faldig ökning av fluorescensintensitet jämfört med oskärmade nanosensorer. K:t + sonder var tvungna att uppvisa hög selektivitet mot Na + , vilket Liu et al. verifierad med den skärmade nanosensorn genom att snabbt detektera konsekvent fluorescenskänslighet för fluktuerande [K + ], medan de förblir opåverkade av ökande [Na + ].
Eftersom levande celler är beroende av natrium-kaliumadenosintrifosfatas (Na + /K + pump) för att upprätthålla en brant [K + ] gradient över deras plasmamembran, processen är delvis ansvarig för cellens energiförbrukning. Defekter i cellulär energimetabolism kan leda till en förlust av [K + ] gradient, samtidigt som det ger upphov till extracellulär [K + ] känd som [K + ] 0, som forskarna övervakade för att få en värdefull indikator på cellviabilitet och tillväxt. Därefter, de ökade nanosensorns specificitet för att upptäcka celldöd eller proliferationshastigheter genom att ympa polyetylenglykol (PEG) på ytan av nanosensorer i ett odlingsmedium som innehåller den mänskliga embryonala njuren 293-cellinjen. De optimerade sedan protokollet genom att förankra ett stort antal nanosensorer på cellmembran med streptavidinkonjugerade nanosensorer till biotinmodifierade celler. Resultaten framhävde förbättrad känslighet hos skärmade nanosensorer för att kontinuerligt övervaka K + utflöde.
K+-avbildningsresultat av den avskärmade nanosensorbehandlade mushjärnan vid initiering av spridning av depression genom KCl-utlösning. Fullängdsvideon är åtta gånger snabbare än den verkliga hastigheten. Kredit:Science Advances, doi:10.1126/sciadv.aax9757 
Teamet använde sedan den avskärmade nanosensorn för att undersöka kortikal spridningsdepression (CSD) i mushjärnan som en vågliknande utbredning av neural aktivitet. Processen involverar vanligtvis en långsam spridning av K + i den kortikala ytan och kan utlösas i mushjärnan via kaliumklorid (KCl) inkubation. Forskarna övervakade samtidigt den lokala fältpotentialen och den optiska signalen genom det kirurgiska kranialfönstret och observerade en våg av ökande [K] + ] 0 fortplantas gradvis över cortex efter stimulering. Liu et al. observerade inte en våg i möss injicerade med oskärmade nanosensorer, vilket indikerar vikten av det yttre filtret för förbättrad känslighet hos nanosensorn. Den registrerade våghastigheten varierade inte nämnvärt från de värden som erhölls med hjälp av blodsyrenivåberoende magnetisk resonanstomografi (MRT) hos patienter med migränanura.
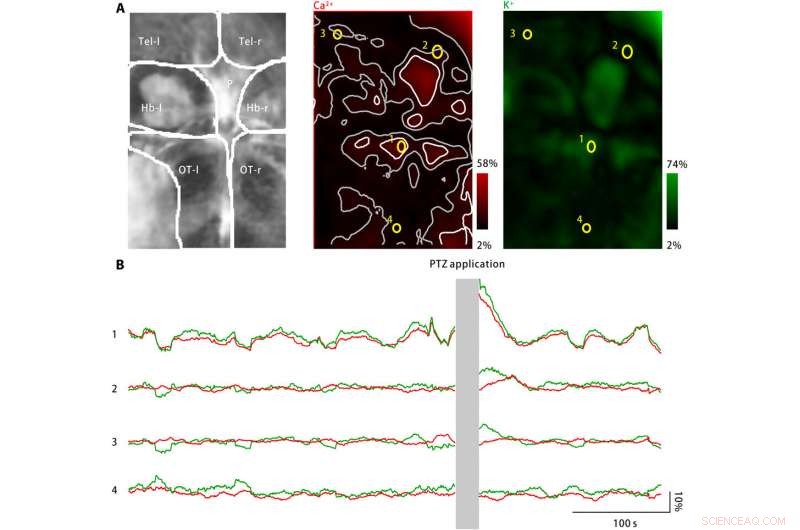
Extracellulärt kalium exploderade i larvzebrafiskhjärnan vid PTZ-behandling. (A) PTZ-behandling inducerade ökningar av både neuronal kalciumaktivitet (mitten) och extracellulär kaliumkoncentration (höger). Vänster:Avbildade hjärnområden inkluderar vänster och höger telencefala (Tel-l och Tel-r, respektive), vänster och höger habenulae (Hb-l och Hb-r, respektive), tallkottkottskroppen (P), och den vänstra och högra optiska tekta (OT-l och OT-r, respektive). Mitten:Neuronal kalciumaktivitet övervakades genom att använda en genetiskt uttryckt kalciumindikator, jRGECO1a. Den uppmätta responsamplituden kodas i rött och mappas tillbaka till den avbildade hjärnregionen. Spridda aktivitetsfläckar är markerade som vita, och deras närliggande zoner är markerade som gråa. Fyra ROI (gul) är valda. Höger:Extracellulär kaliumkoncentration övervakades med hjälp av kaliumnanosensorn. Den uppmätta responsamplituden är kodad i grönt och mappas tillbaka till den avbildade hjärnregionen. (B) Neuronal kalciumaktivitet (röd) och extracellulära kaliumkoncentrationer som observerats för de fyra representativa ROI är markerade i (A). Efter PTZ-applikation, både neuronal kalciumaktivitet och extracellulär kaliumkoncentration har ökat vid flera aktivitetspunkter, inklusive tallkottkottskroppen och den främre optiska tecta, som representeras av ROI1. I närliggande zoner av aktivitetsplatserna, förändring av neuronal kalciumaktivitet är frånvarande eller minimal, medan den extracellulära kaliumkoncentrationen fortsätter att öka (ROI2 och ROI3). Dock, i området långt från aktivitetsplatserna (ROI4), varken neuronal kalciumaktivitet eller extracellulär kaliumkoncentration har ökat. Kredit:Science Advances, doi:10.1126/sciadv.aax9757
För att utöka tillämpningarna av nanosensorn, Liu et al. övervakade neuronala kalciumnivåer och extracellulära kaliumkoncentrationer med hjälp av zebrafisklarver. Medan en stor ökning av den extracellulära kaliumkoncentrationen kan orsaka intensiv neuronal aktivering för att orsaka CSD och epilepsi, inga direkta bevis finns för att visa förändringar i extracellulärt kalium under sjukdomen. Teamet konstruerade därför en sjukdomsmodell med zebrafisklarver för att öka extracellulära kaliumkoncentrationer och observerade sjukdomskarakteristisk neuronal aktivering i specifika hjärnregioner.
På det här sättet, Jianan Liu och kollegor konstruerade en kaliumjon nanosensor med extremt hög känslighet och selektivitet. Den yttre beläggningen av ett selektivt filtermembran förbättrade selektiviteten, känslighet, och kinetik för anordningen för snabb och kvantitativ [K + ] upptäckt i levande celler och intakta hjärnor. Den avskärmade nanosensorn kommer att ha breda tillämpningar inom hjärnforskning för att förbättra förståelsen av onormala [K] + ]-relaterade sjukdomar. Metoden tillsammans med optisk fiberbaserat endoskop och fotometri kommer att möjliggöra kaliumavbildning i realtid i fritt rörliga djur.
© 2020 Science X Network