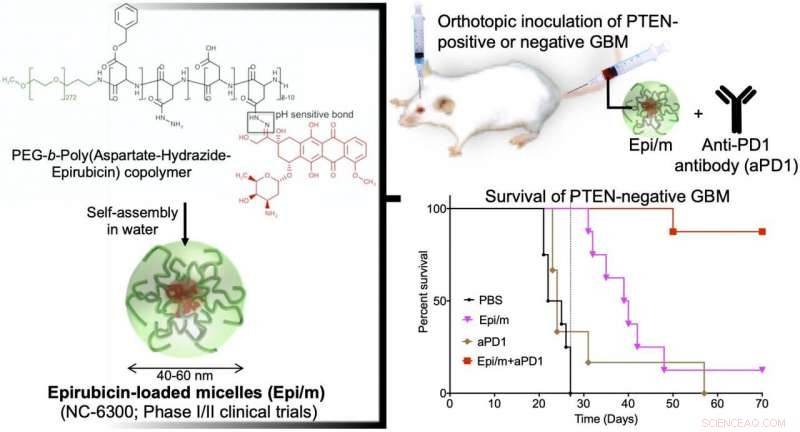
Vänster:Hydrofobt epirubisin är konjugerat till ena änden av hydrofil polyetylenglykol (PEG) kedja med aspartat-hydrazid som en länk. I vatten, denna molekyl är självmonterad för att bilda nano-miceller (Epi/m). Uppe till höger:PTEN(+) eller PTEN(-) GBM transplanterades in i hjärnan på möss, och Epi/m och anti-PD1-antikropp (aPD1) administrerades genom svansvenen för att utvärdera överlevnadsperioden. Nederst till höger:Jämförelse av överlevnadsperiod vid PTEN(-)GBM. PBS (fosfatbuffertlösning) administrerades till kontrollgruppen. Som ett resultat, ingen av kontrollgruppen (svart) kunde överleva mer än 30 dagar (8/8). Enbart Epi/m-gruppen (rosa) dog gradvis efter 30 dagar, hälften (4/8) på 40 dagar, och 7/8 med 50 dagar. enbart aPD1 (brun) dödade 6/7 inom 30 dagar. I kontrast, med Epi/m+aPD1 (röd), 1/8 dog 50 dagar senare, men 7/8 levde efter 3 månader till och med. Kredit:2020 Innovation Center of NanoMedicine
En nanomedicin-baserad strategi för kemo-immunoterapi (CIT) av glioblastom (GBM), som har den sämsta prognosen bland hjärntumörer, utvecklades framgångsrikt. In vivo-experiment visade att den kombinerade användningen av epirubicin-inkapslande nano-miceller (Epi/m) med immunkontrollpunktshämmare (ICI) utrotade PTEN-negativ GBM, som är mycket resistent mot enbart ICI. På grund av de synergistiska effekterna av kombinationen Epi/m plus ICI, antalet tumörinfiltrerande T-celler (TIL) och andra antitumörimmunceller ökade signifikant för att effektivt döda cancerceller.
Å andra sidan, intratumorala benmärgshärledda immunsuppressiva celler (MDSC), som stör immunsvaret, reducerades avsevärt. CIT gav också robusta immunologiska minneseffekter mot tumörerna, som effektivt avvisade nyligen implanterade PTEN-negativa GBM-celler i hjärnan. Medan fritt epirubicin kan orsaka skador på organ, inklusive hematopoetiska organ, särskilt, vår nanomedicinstrategi minskade dessa biverkningar avsevärt, förbättra immunsvaret. Epi/m har redan avancerat till kliniska prövningar för andra cancertyper, och denna CIT-strategi kan förväntas översättas till klinisk utvärdering i framtiden. Dessa resultat har publicerats i ACS Nano den 6 augusti av American Chemical Society.
The Innovation Center of Nanomedicine (direktör:Prof. Kazunori Kataoka, Plats:Kawasaki-City, Förkortning:iCONM) meddelade att ett nytt terapeutiskt alternativ för glioblastom (GBM) demonstrerades hos möss, i en samarbetsstudie med Institutionen för bioteknik, Civilingenjörshögskolan, Tokyos universitet. GBM är en hjärntumör med extremt snabb progression och dålig prognos (5-års överlevnad:10,1%). Även om flera föreningar utvärderas i kliniska studier, det finns inget terapeutiskt alternativ för att signifikant förbättra överlevnadsperioden. Särskilt, patienter med abnormiteter i PTEN-genen, en av cancersuppressorgenerna, är mycket resistenta mot för närvarande tillgängliga terapier och har höga medicinska behov.
I allmänhet, immunkontrollpunktshämmare (ICI) anses vara ineffektiva mot GBM, eftersom GBM är immunsuppressivt med låg T-cellsinfiltration. I den metod som presenteras i denna artikel, iCONMs nanoläkemedelsleveransteknologi möjliggör selektiv tumörackumulering av epirubicin, som orsakar immunogen celldöd (ICD), till tumörvävnader, vari, orsakar ICD lokalt för synergisering med ICI. Som ett resultat, denna nanomedicinbaserade kemo-immunoterapi (CIT) var effektiv på möss transplanterade med GBM i hjärnan (nedan kallad mus GBM-modell), och lyckades signifikant förlänga möss överlevnad. Kombinationen av de epirubicin-laddade nano-micellerna behandlade möss visade hög infiltration av cytotoxiska T-celler (TIL) och minskade benmärgshärledda immunsuppressiva celler (MDSC). Så småningom observerades undertryckande av immunkontrollpunktsfunktionen.
Mutationer i PTEN-genen förekommer ofta i GBM, vilket resulterar i immunsuppressiva vägar som främjar motståndet mot ICI. Således, medan ICI utrotade 40% av tumörerna i en mus GBM-modell där PTEN-genen är normal, i en modell där PTEN-genen slogs ut, ICI kunde inte förlänga möss överlevnad. På cellnivå, det visade sig att PTEN-bristceller (CT2A-luc) uttryckte ungefär 5 gånger mer PDL1 än hos normala celler, vilket troligen är kopplat till den terapeutiska resistensen med ICI. Eftersom epirubicin har visat förmågan att undertrycka PDL1-uttryck i tumörer, såsom bröstcancer, det skulle vara möjligt att minska PDL1-nivåerna av GBM om tillräcklig mängd epirubicin kan levereras till GBM-lesioner. Således, CIT med användning av nanomiceller innehållande epirubicin (Epi/m) i kombination med ICI användes för att förbättra antitumöreffektiviteten mot GBM.
I en GBM-modell med normalt PTEN-uttryck (GL261-luc), Epi/m (5 mg/kg på Epi-basis) plus anti-PD1-antikroppar (5 mg/kg) resulterade i att alla möss överlevde i mer än 70 dagar, med en anmärkningsvärd förlängning av överlevnadstiden. I denna modell, PBS-behandlade möss dog inom 30 dagar, möss behandlade med enbart anti-PD1-antikroppar (5 mg/kg) tillät 40 % av mössen att överleva i minst 70 dagar, och Epi/m (5 mg/kg Epi-bas) gav 80 % av mössen överlevnad i mer än 70 dagar. I kontrast, i modellen med PTEN-brist (CT2A-luc), Epi/m (5 mg/kg på Epi-basis) plus anti-PD1-antikroppar (5 mg/kg) resulterade i att endast 30 % av mössen överlevde i mer än 70 dagar, och ingen tydlig överlevnadseffekt kunde bekräftas för de andra kontrollgrupperna. När dosen ökades till 15 mg/kg Epi/m (i Epi-basis) och kombinerades med anti-PD1-antikroppar (5 mg/kg), 90 % av mössen kunde överleva i mer än 70 dagar, anmärkningsvärt förlänger möss överlevnad.