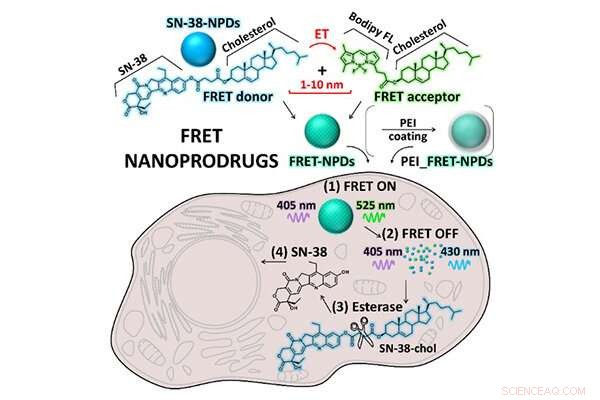
Intracellulär undersökning av FRET NPD. Kredit:Tohoku University
Majoriteten av läkemedelstillförselsystem använder nanobärare för att transportera läkemedel på grund av deras ringa storlek och förmåga att distribuera läkemedel till annars otillgängliga platser i kroppen. Nackdelen med denna lilla storlek, dock, är att stora mängder behövs för att matcha den erforderliga dosen.
Alternativa bärarfria system, känd som nanodroger (NPD), visa enorma löften för cancerbehandling. Till exempel, en SN-38 NPD har cirka 10 gånger högre anticancereffektivitet än kommersiellt tillgängliga läkemedel. Nu, forskare har, för första gången, utvecklat en omfattande studie om dynamiken hos SN-38 NPDs inuti cancerceller, inklusive deras internaliseringshastighet, intracellulär lokalisering, och nedbrytning, såväl som deras terapeutiska effektivitet.
"Dessa innovativa system visar hög anticanceraktivitet, men kunskapen grundläggande för klinisk översättning, som deras interaktion med cancerceller, fortfarande saknades, sa professor Hitoshi Kasai, medförfattare till studien.
Forskargruppen utvärderade tillståndet för NPD i cancerceller med hjälp av Förster Resonance Energy Transfer (FRET) baserad mikroskopiteknik. FRET förlitar sig på energiöverföringen mellan två ljuskänsliga molekyler. Utnyttja den fluorescerande egenskapen hos SN-38 tillsammans med Bodipy FL-fluorescensproben i NPD:erna som är speciellt utformade för denna studie, FRET tillät forskarna att observera tillståndet för NPD från intakt partikel till den upplösta prodrugen.
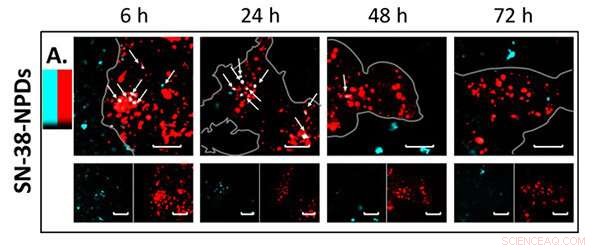
Fluorescensbilder av NPD (i blått) som samlokaliserar och nedbryts inuti lysosomer (i rött) över tiden. Kredit:Tohoku University
Konfokal lasermikroskopobservation bekräftade signifikant NPD-nedbrytning från intakt tillstånd till en upplöst prodrug inuti cellerna över tid. Detta innebär att NPD konsekvent absorberades av celler som intakta partiklar innan de transporterades in i lysosomerna - en membranbunden organell som innehåller matsmältningsenzymer. Väl inne i lysosomerna, SN-38 prodrug löstes upp från en intakt partikel (Figur 2) och utförde sina terapeutiska effekter på cancercellerna.
Kasai tillägger att "Våra verk ger en omfattande översikt över dynamiken hos prodrug-nanopartiklar inuti cancerceller, vilket möjliggör ytterligare framsteg mot deras tillämpning som nästa generations anordningar för läkemedelstillförsel mot cancer."