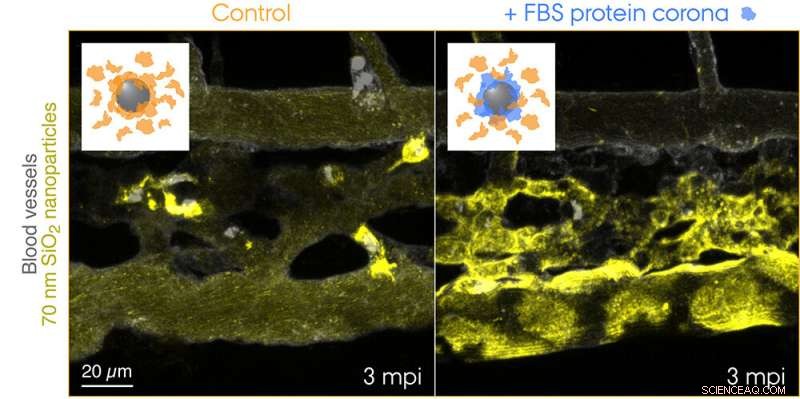
Fluorescensmärkta 70 nm SiO2-nanopartiklar injicerades i blodomloppet hos 3 dagar gamla transgena zebrafiskembryon och avbildades live 3 minuter efter injektionen. Insättningarna visar scheman för de två testade tillstånden:kontrollnanopartiklar med en korona av endogena proteiner (orange) och nanopartiklar med en förbildad korona av fetalt bovint serum (FBS) proteiner (blått) och ytterligare endogena proteiner. Kontrollnanopartiklar fångas snabbt av makrofager, medan nanopartiklarna med en icke-självbiologisk identitet effektivt sekvestreras av endotelceller som rensar. Kredit:Yuya Hayashi. Anpassad från Mohammad-Beigi et al. (2020) ACS Nano. Copyright 2020 American Chemical Society
En mängd olika nanopartiklar är designade för riktad läkemedelsleverans, men tyvärr är det bara en mycket liten del av de injicerade nanopartiklarna som når målplatsen, såsom solida tumörer. Orsaken bakom den låga inriktningseffektiviteten anses ofta vara en "svart låda" och hade därför varit lite utforskad under många år.
Nyligen, en internationell forskargrupp ledd av Yuya Hayashi från Institutionen för molekylärbiologi och genetik (MBG), Århus universitet, demonstrerade skönheten hos zebrafiskembryon i nano-bioavbildning som kan visualisera dynamiska interaktioner mellan nanopartiklar och celler av intresse i en levande organism (se en annan artikel "Zebrafisk låter dig se det biologiska ödet för nanopartiklar in vivo").
Nu, samarbetar med forskare från Interdisciplinary Nanoscience Center (iNANO), Yuya försöker svara på olösta mysterier inom bionanovetenskap - den första i raden är det biologiska identitetskonceptet, som förklarar hur celler känner igen nanopartiklar genom en "corona" av proteiner som omger varje partikel. Detta koncept har nu bevisats för första gången i en levande organism genom att använda embryon från zebrafisk som avslöjar vad som händer med nanopartiklar som injiceras i blodet.
Vän eller fiende? Hur biologiska system känner igen nanopartiklar
"What the Cell Sees in Bionanoscience" är en av de tidiga publikationerna som har definierat hur en korona av proteiner bildas runt en nanopartikel och hur en sådan proteincorona innebär behovet av att ompröva hur vi ser på nanopartiklar i en biologisk miljö. Från omfattande forskning under det senaste decenniet, vi förstår nu att två motsatta effekter främst bidrar till nanopartikelupptag av celler. I allmänhet, proteinet corona förhindrar nanopartikelytan från direkt fysisk interaktion med cellmembranet. Dock, vad händer om proteinet corona presenterar en signal som utlöser en specifik biologisk interaktion med receptorer utplacerade på cellmembranet? Det är något cellen ser och därmed ger nanopartikeln en biologisk identitet.
Nu har forskarna från Aarhus Universitet alltså gett de första "visuella" bevisen för proteinets koronas slående bidrag till clearance av nanopartiklar från blodet som medförde negativa utfall i zebrafiskembryomodellen. Forskargruppen använde en proteinkälla som inte matchar arten för koronabildningen för att skapa en "icke-själv" biologisk identitet och spårade resan för nanopartiklar som färdades genom blodet och till deras slutdestination - endolysosomer i cellen. Detta avslöjade förvånansvärt snabbt upptag och försurning av nanopartiklarna av renande endotelceller (funktionell motsvarighet till leverns sinusformade endotelceller hos däggdjur) följt av pro-inflammatorisk aktivering av makrofager (se filmen på Yuyas gruppwebbsida).
"Det låter som en galen idé att injicera nanopartiklar med proteiner från ett annat djur, säger Yuya, "men t.ex. biomolekyl-inspirerade nanoläkemedel testas i en musmodell utan särskilda bekymmer för kombinationen av artfel. Eller så humaniserar några smarta människor musen för att ta hand om artkompatibilitetsproblemet. Faktiskt, även på cellodlingsnivå testas nanopartiklar fortfarande rutinmässigt enligt traditionen att använda serumtillskott från kor samtidigt som man vet att interaktioner mellan nanopartiklar och protein är en nyckelfaktor för cellulärt upptag."
"Det som gör den här typen av experiment ganska utmanande är, ", tillägger förstaförfattaren Hossein Mohammad-Beigi, "för att maximalt behålla det ursprungliga proteinet corona i en levande organism. Om den förbildade koronan snabbt byts ut mot endogena blodproteiner, den testade hypotesen blir ogiltig. Vi har gjort en hel del ansträngningar för att karakterisera proteinet corona för att säkerställa att nanopartiklarna bevarar den icke-självbiologiska identiteten."
Att se är att tro – zebrafiskmodellen kan erbjuda vad gnagarmodeller inte kan
Den största fördelen med zebrafiskmodellen är dess kraft i realtidsavbildning i flera färger, varvid flera kombinationer av fluorescensspårare och reporterproteiner kan avbildas i en enkel uppsättning med hög rums-temporell upplösning. Detta ger en ny möjlighet som ligger mellan mindre realistiska cellodlingssystem och mer utmanande gnagarexperiment som intravital mikroskopi.
"Med hjälp av cellkulturer, vi har lärt oss ganska mycket om hur celler känner igen nanopartiklar snarare som dynamiska aggregat av proteiner men det testades aldrig i en mer realistisk situation, " Yuya förklarar. "Med etableringen av zebrafiskmodellen, vi har äntligen skaffat oss ett sätt att ytterligare utforska denna fråga i en levande organism. Det var ett enkelt tillvägagångssätt med ett extremt scenario testat i ett mycket komplext system, men jag tror att vi nu är ett steg närmare att förstå vad proteinet corona verkligen kan betyda för nanopartiklar. I en miljö rik på proteiner, nanopartiklar kan bära en mask som ger dem en biologisk identitet, och dess icke-självhet kan göra dem till en fiende. Vad definierar graden av icke-självhet? Väl, det är nästa stora fråga vi måste ta itu med."