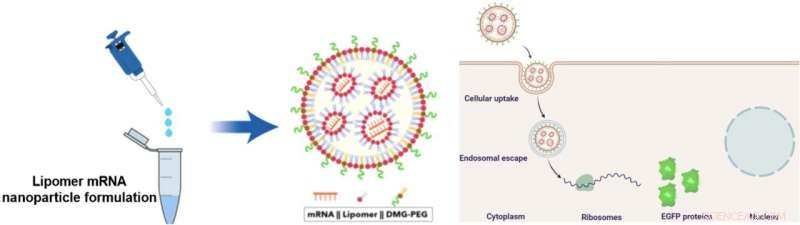
Lipomeren kombineras med mRNA och DMG-PEG för att bilda mRNA-bärande nanopartiklar (NP). Dessa NP kan kringgå levern för att leverera mRNA direkt till lungceller. Forskarna använde mRNA som kodar för förbättrat grönt fluorescerande protein (EGFP) för visualisering av proteinerna. Kredit:Mahmoud M. Abd Elwakil, et al., Material horisonter . 7 juni, 2021
Forskare från Hokkaido University i Japan skapade och testade ett bibliotek av lipidbaserade föreningar för att hitta ett sätt att säkert och effektivt leverera RNA-läkemedel till lungorna. Deras analyser, publicerad i tidskriften Materials Horizons, hittade en lipidpolymer som i framtiden kan användas för att behandla akut andnödsyndrom, pulmonell hypertoni och lungcancer.
Reaktionen på covid-19-pandemin har gjort oss alla bekanta med RNA-vacciner som bär genetisk kod in i celler för att få fram produktionen av virusproteiner som utlöser vår skyddande immunitet. RNA-läkemedel visar stor potential för att behandla ett stort antal andra sjukdomar genom att på liknande sätt styra proteinproduktionen inuti celler, utan att behöva infoga eller radera DNA. Men forskare står inför flera utmaningar i sin säkra leverans till målceller. Ett framgångsrikt men komplext tillvägagångssätt innebär att bära RNA-koderna inuti nanopartiklar täckta med föreningar, kallade målsökande ligander, som kan binda till specifika celler. Detta har fungerat för att rikta in sig på leverceller.
Hokkaido Universitys läkemedelsforskare Hideyoshi Harashima och polymerkemist Toshifumi Satoh ledde ett team av forskare i att utveckla och testa ett bibliotek av ε-dekalaktonbaserade föreningar, lipider som kan kringgå levern - vilket bryter ned gifter och främmande ämnen - och specifikt leverera RNA-kod till lungorna. Harashima fick nyligen Høst-Madsen-medaljen, den högsta vetenskapliga utmärkelsen som tilldelas av The International Pharmaceutical Federation (FIP).

Fritt mRNA riktade sig inte mot något organ (vänster), medan NPs innehållande lipomer AA03-DL-10 specifikt transporterade mRNA som kodar för EGFP till lungorna och producerade grönt fluorescerande proteiner åtta timmar efter intravenös administrering till möss. Kredit:Mahmoud M. Abd Elwakil, et al., Material horisonter , 7 juni, 2021
Forskarna arbetade med två närbesläktade ringformade föreningar:ε-kaprolakton och ε-dekalakton. Lipidnanopartiklar (NP) som innehåller dessa laktoner har tidigare visat sig ackumuleras i lungorna. De utsattes för ringöppnande reaktioner med en av elva aminoalkoholer. De resulterande produkterna klassificerades ytterligare på basis av molekylvikten för varje arm. Produkterna kombinerades med mRNA och en annan förening kallad DMG-PEG för att bilda mRNA-bärande NP. NP tillverkade av ε-kaprolakton var instabila, så laget fortsatte enbart med NP från ε-dekalakton.
Teamet testade leveransen av RNA-bärande ε-dekalakton-NP:er först i laboratoriecancerceller och sedan intravenöst i möss. De använde mRNA som kodar för förstärkt grönt fluorescensprotein (EGFP) för att identifiera destinationen för NP:erna. I sista hand, de fann att ε-dekalakton i kombination med en linjär aminoalkohol som kallas AA03 gav det bästa resultatet. Undersökningarna visade att NP som innehöll denna lipomer till stor del kunde kringgå levern och transportera RNA-materialet specifikt in i lungorna. NP:erna uppslukades av cellmembranet och RNA-innehållet släpptes in i lungcellernas cytoplasma.
"Vi visade att en utvidgning av det kemiska utrymmet för smarta material kan möjliggöra tillverkning av nanopartiklar för svåråtkomliga mål utan behov av inriktningsligander, ", säger Harashima. "Att designa kombinatoriska bibliotek som tillhandahåller olika ε-dekalaktonlipomerer kan vara en enkel och skalbar strategi för utvecklingen av nästa generations genterapier för organ bortom levern."