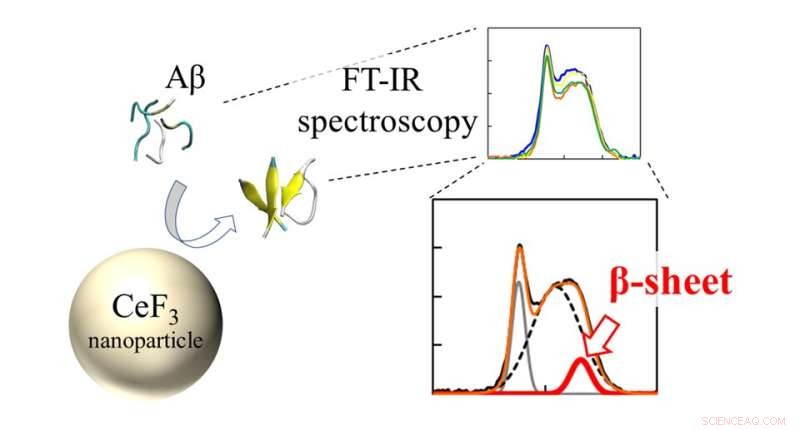
Infraröda (FT-IR) spektra och β-arkförhållande för Ap-peptider interagerade med CeF3 NPs. Effekten av CeF3-nanopartiklar på amyloid betaproteinstruktur mäts direkt med FT-IR-spektroskopi. Bildandet av sekundär struktur visar sig som en egenskap i IR-spektrumet. Kredit:Masakazu Umezawa / Tokyo University of Science, Licenstyp:CC BY 4.0
Proteinfunktion och aktivitet bestäms av både deras sammansättning och sekundära struktur. Avvikelser relaterade till antingen proteinaggregation eller sekundär struktur kan leda till neurodegenerativa sjukdomar. I en ny studie avslöjar ett internationellt forskarlag hur fluoridnanopartiklar, material som används vid in vivo-avbildning, påverkar sammansättningen och strukturen av amyloid-β-proteinet. Deras resultat är ett steg mot bättre behandling och förebyggande av neurologiska sjukdomar som Alzheimers sjukdom.
Självmontering, eller sammanslutningen av enskilda enheter av ett material till ordnade strukturer eller mönster, är ett fenomen av stort forskningsintresse för materialvetare. Ett framträdande exempel på självmontering kommer från självmontering av proteiner i biologiska system. Funktionen och aktiviteten hos proteiner styrs av deras sammansättningstillstånd. Dessutom spelar proteinets "sekundära struktur", som kännetecknas av dess vikning till strukturer, såsom ett β-ark, också en roll. Faktum är att abnormiteter i proteinets sekundära strukturer eller deras sammansättning kan leda till olika neurodegenerativa sjukdomar, inklusive Alzheimers sjukdom.
Nanopartiklar (NP) erbjuder en lovande väg för behandling och förebyggande av sådana sjukdomar genom att tillåta en kontrollerad och riktad läkemedelsleverans. Dessutom används oorganiska NPs, såsom fluorid NPs, i hjärnavbildningstillämpningar. Jämfört med organiska NP:er anses oorganiska NP:er vara en bättre kandidat för att utveckla högfunktionella material. Men det finns mycket oro angående deras biotoxicitet. Även om deras interaktioner med bioproteiner har studerats, är mekanismen bakom dessa interaktioner inte väl förstått.
Ett internationellt team av forskare från Tokyo University of Science (TUS) i Japan och Nazarbayev University i Kazakstan har nu tagit itu med denna fråga. I deras studie, som gjordes tillgänglig online den 2 juni 2022 och publicerades i tidskriften ACS Applied Bio Materials den 20 juni 2022 undersökte teamet en sektion av amyloid-β-peptiden (ett protein som finns i plack som bildas i hjärnan hos patienter med Alzheimers sjukdom) i en lösning med fluoridkeramik (CeF3 ) NPs. Studien leddes av juniordocent Masakazu Umezawa och inkluderade bidrag från Naoya Sakaguchi från TUS och biträdande professorerna Mehdi Amouei Torkmahalleh och Dhawal Shah från Nazarbayev University.
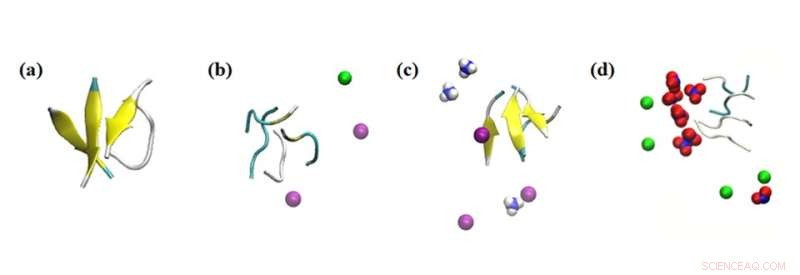
Simuleringsögonblicksbilder av peptidaggregatets interaktioner med olika joner. Simuleringsresultat av effekten av joner inom 0,1 nm på peptiderna i systemen som studeras:(a) inget salt, (b) 0,15 M NaCl, (c) 0,15 M NH4Cl och (d) 0,15 M NaNO3. Färg:betaark =gul; Na+ =grön; NH4+ =blått och vitt; Cl- =lila; och NO3− =blått och rött. Kredit:Masakazu Umezawa / Tokyo University of Science, Licenstyp:CC BY 4.0
Teamet använde en teknik som kallas "Fourier transform infrared spectroscopy" (FTIR) för att direkt övervaka effekten av NP-ytan på peptidbindningarna. "Vi fann att nära nanopartikelytan är det mer sannolikt att peptider bildar β-skivor. Detta kommer som en effekt av hydrofobicitet. De delar av peptiden som stöts bort av vattenlösningen fastnar på nanopartiklarna och bildar aggregat lättare." förklarar Dr Umezawa.
Dessutom undersökte teamet effekten av andra omgivande joner i lösningen. "Det vi hittade var mycket överraskande. Även utan nanopartiklarna påverkade miljön hastigheten för sekundär strukturbildning", säger Dr Umezawa, "Denna effekt, som härrörde från en kombination av elektrostatisk interaktion och vätebindning, överdrevs vid tillsats av nanopartiklar. Med ett noggrant val av joner och nanopartiklar kan β-skiktbildningen antingen undertryckas eller främjas. Detta innebär att processen kan kontrolleras och konstrueras för att utrota negativa effekter."
De experimentella resultaten kompletterades med simuleringar av molekylär dynamik utförda av Nazarbayev University-teamet. Detta i sin tur hjälpte till att utforma och vägleda experimenten samt ge insikter i resultaten.
Med denna djupare förståelse av interaktionen mellan proteiner och NP banar studien vägen för kontrollerade proteinveckningsprocesser. Med sådan kontroll skulle alla proteindeformationer kunna elimineras och positiva interaktioner och strukturella förändringar kan främjas. Detta kan leda till ett bättre förebyggande och behandlingsprotokoll för Alzheimers sjukdom och, så småningom, till en bättre livskvalitet för äldre vuxna. + Utforska vidare