SENT-seq använder ortogonala fångstsekvenser för att generera avstämbara multiomiska avläsningar. Kredit:Nature Nanotechnology (2022). DOI:10.1038/s41565-022-01146-9
Terapeutik baserad på budbärar-RNA, eller mRNA, kan potentiellt behandla ett brett spektrum av sjukdomar, inklusive cancer, genetiska sjukdomar, och som världen har lärt sig under de senaste åren, dödliga virus.
För att fungera måste dessa läkemedel levereras direkt till målceller i nanoskala bubblor av fett som kallas lipid nanopartiklar, eller LNP-mRNA är inte mycket bra om inte når rätt celltyp.
Ett team av forskare vid Georgia Institute of Technology och Emory University's School of Medicine har tagit ytterligare ett steg mot att förbättra utvecklingen av dessa skräddarsydda leveransfordon, och rapporterade sitt arbete den 30 juni i Nature Nanotechnology . Curtis Dobrowolski och Kalina Paunovska, praktikanter i James Dahlmans labb, har utvecklat ett system för att göra prekliniska nanopartikelstudier mer prediktiva. Deras upptäckter påverkar redan forskningens inriktning inom detta växande, konkurrensutsatta område.
"Jag är väldigt exalterad över den här studien och förväntar mig att flytta de flesta av våra framtida projekt till den här metoden", säger Dahlman, docent och McCamish Foundation Early Career Professor vid Wallace H. Coulter Department of Biomedical Engineering vid Georgia Tech and Emory.
Sekvensering av händelser
Under de senaste åren har Dahlman samarbetat med Coulter BME-professor Philip Santangelo i ett hektiskt forskningsföretag. Santangelos labb utvecklar mRNA-terapier och Dahlmans labb levererar det med hjälp av LNP.
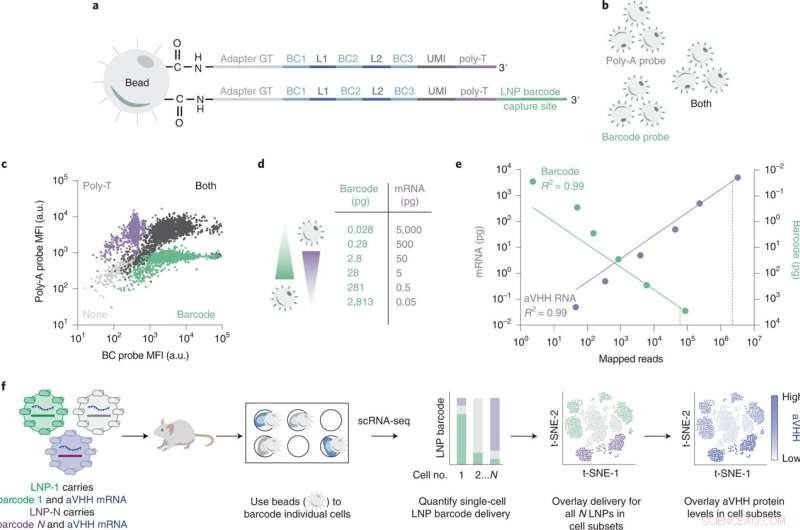
För att påskynda processen att testa effektiviteten av deras LNP:er har Dahlmans team utvecklat en teknik som kallas DNA-streckkodning. I denna process infogar forskare en DNA-bit som motsvarar en given LNP. LNP:erna injiceras sedan och cellerna undersöks därefter med avseende på närvaron av "streckkoderna" med hjälp av genetisk sekvensering. Systemet identifierar vilka streckkoder som har nått vilka specifika mål, och lyfter fram de mest lovande nanopartiklarna. Eftersom många DNA-sekvenser kan läsas samtidigt tillåter streckkodningsprocessen många experiment att utföras samtidigt, vilket påskyndar upptäckten av effektiva bärare av lipidnanopartiklar.
DNA-streckkodning har avsevärt förbättrat den prekliniska screeningsprocessen för nanopartiklar. Men det finns fortfarande en betydande barriär som påverkar läkemedelsleveransen. På grund av sin mångfald är celler ungefär som rörliga mål. Dahlman noterade att celler som tidigare ansågs vara homogena är sammansatta av distinkta och varierade cellundergrupper. Hans team antog att denna kemiska och genetiska heterogenitet har ett kraftfullt inflytande på hur väl LNP:er kan leverera mRNA-terapier in i cellerna.
"Celler har inte bara ett protein som definierar dem - de är komplicerade," sa Dahlman. "De kan definieras av en kombination av saker, och om vi ska vara ärliga, definieras de bäst med hjälp av alla gener som de gör eller inte uttrycker."
För att testa sin hypotes utvecklade forskarna ett nytt verktyg för att mäta alla dessa saker på en gång. Deras multiomiska nanopartikelleveranssystem kallas single-cell nanopartikel targeting-sequencing, eller SENT-seq.
Multiomics-metoden
Med hjälp av SENT-seq kunde forskarna kvantifiera hur LNP levererar DNA-streckkoder och mRNA till celler, den efterföljande proteinproduktionen som underlättas av mRNA-läkemedlet, såväl som cellens identitet, i tusentals enskilda celler.
Denna multiomics-metod kan representera ett viktigt steg framåt för upptäckt av LNP med hög genomströmning. SENT-seq-tekniken gjorde det möjligt för teamet att identifiera cellsubtyper som visar särskilt högt eller lågt upptag av nanopartiklar, och generna associerade med dessa subtyper.
Så, förutom att testa effekten av ett läkemedel och hur vissa cellsubtyper reagerar på nanopartiklar, identifierar de vilka gener som är involverade i det framgångsrika upptaget av LNP. Och de gör allt på en gång.
"Data antyder att dessa olika cellundergrupper har distinkta svar på nanopartiklar som påverkar hur väl en mRNA-terapi fungerar," sa Dahlman. "Det finns fortfarande mycket arbete kvar att göra, men vi tror att möjligheten att samtidigt läsa ut högkapacitetsleverans av nanopartiklar och cellulär respons på nanopartiklar kommer att leda till bättre mRNA-terapier."
Co-lead author Paunovska said that she and Dobrowolski came up with the idea for the SENT-seq system, "organically, after two months of working together."
Dahlman added:"I'm proud of the work that Curtis, Kalina, and the team did in the lab. I think this is the beginning of an extremely interesting phase in our work." + Utforska vidare