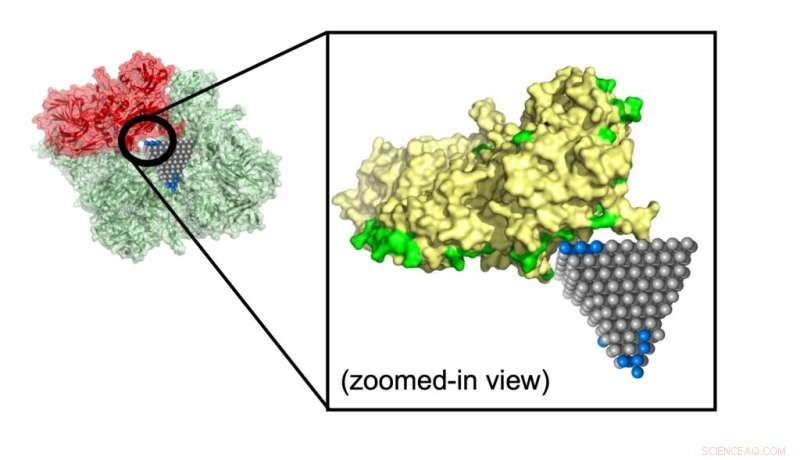
Modellen förutspådde hur en zinkoxidnanopyramid avbryter ett protein som bidrar till metabolismen i MRSA (meticillinresistent Staphylococcus aureus), en vanlig stam som orsakar antibiotikaresistenta infektioner. Kredit:Minjeong Cha och Emine Sumeyra Turali Emre, Kotov Lab
Med antibiotikaresistenta infektioner på uppgång och ett ständigt föränderligt pandemivirus är det lätt att se varför forskare vill kunna designa konstruerade nanopartiklar som kan stänga av dessa infektioner.
En ny maskininlärningsmodell som förutsäger interaktioner mellan nanopartiklar och proteiner, utvecklad vid University of Michigan, tar oss ett steg närmare den verkligheten.
"Vi har ombildat nanopartiklar till att vara mer än bara läkemedelsleveranser. Vi anser dem vara aktiva droger i och för sig", säger J. Scott VanEpps, biträdande professor i akutmedicin och författare till studien i Nature Computational Vetenskap .
Att upptäcka droger är en långsam och oförutsägbar process, vilket är anledningen till att så många antibiotika är variationer på ett tidigare läkemedel. Läkemedelsutvecklare skulle vilja designa läkemedel som kan attackera bakterier och virus på sätt som de väljer, och dra nytta av de "lås-och-nyckel"-mekanismer som dominerar interaktioner mellan biologiska molekyler. Men det var oklart hur man skulle övergå från den abstrakta idén att använda nanopartiklar för att störa infektioner till praktisk implementering av konceptet.
"Genom att tillämpa matematiska metoder på protein-protein-interaktioner har vi effektiviserat designen av nanopartiklar som efterliknar ett av proteinerna i dessa par", säger Nicholas Kotov, professor vid Irving Langmuir Distinguished University i kemivetenskap och teknik och motsvarande författare till studien. .
"Nanopartiklar är mer stabila än biomolekyler och kan leda till helt nya klasser av antibakteriella och antivirala medel."
Den nya maskininlärningsalgoritmen jämför nanopartiklar med proteiner med hjälp av tre olika sätt att beskriva dem. Medan den första var en konventionell kemisk beskrivning, visade sig de två som gällde struktur vara viktigast för att göra förutsägelser om huruvida en nanopartikel skulle vara en lås-och-nyckel-matchning med ett specifikt protein.
Mellan dem fångade dessa två strukturella beskrivningar proteinets komplexa yta och hur det kan omkonfigurera sig för att möjliggöra lås-och-nyckel-passningar. Detta inkluderar fickor som en nanopartikel skulle kunna passa in i, tillsammans med storleken som en sådan nanopartikel skulle behöva vara. Beskrivningarna inkluderade även kiralitet, en vridning medurs eller moturs som är viktig för att förutsäga hur ett protein och en nanopartikel kommer att låsa sig.
"Det finns många proteiner utanför och inuti bakterier som vi kan rikta in oss på. Vi kan använda den här modellen som en första screening för att upptäcka vilka nanopartiklar som kommer att binda till vilka proteiner", säger Emine Sumeyra Turali Emre, postdoktor i kemiteknik och co-first. författare till tidningen, tillsammans med Minjeong Cha, en Ph.D. student i materialvetenskap och teknik.
Emre och Cha förklarade att forskare kunde följa upp matchningar som identifierats av deras algoritm med mer detaljerade simuleringar och experiment. En sådan matchning skulle kunna stoppa spridningen av MRSA, en vanlig antibiotikaresistent stam, med hjälp av zinkoxidnanopyramider som blockerar metabola enzymer i bakterierna.
"Machine learning algoritmer som vår kommer att tillhandahålla ett designverktyg för nanopartiklar som kan användas i många biologiska processer. Hämning av viruset som orsakar covid-19 är ett bra exempel", sa Cha. "Vi kan använda den här algoritmen för att effektivt designa nanopartiklar som har bredspektrum antiviral aktivitet mot alla varianter."
Detta genombrott möjliggjordes av Blue Sky Initiative vid U-M College of Engineering, som gav stöd till det tvärvetenskapliga teamet som genomförde den grundläggande utforskningen av huruvida ett tillvägagångssätt för maskininlärning kan vara effektivt när data om den biologiska aktiviteten hos nanopartiklar är så sparsam.
"Kärnan i Blue Sky-idén är exakt vad det här arbetet omfattar:att hitta ett sätt att representera proteiner och nanopartiklar i ett enhetligt tillvägagångssätt för att förstå och designa nya klasser av läkemedel som har flera sätt att arbeta mot bakterier", säger Angela Violi, en Arthur F. Thurnau Professor, professor i maskinteknik och ledare för nanobiotikaprojektet Blue Sky.
Samarbetspartners vid University of California, Los Angeles bidrog också till maskininlärningsalgoritmen. + Utforska vidare