Att para ihop järnoxidnanopartiklar med väteperoxid resulterar i en exakt riktad behandling för att döda skadliga orala bakterier, bryta ner tandplack och till och med diagnostisera skadliga orala biofilmer, enligt en ny studie. Kredit:Med tillstånd av studieförfattarna
En växande mängd bevis pekar på ett samband mellan järnbristanemi och allvarligt karies. Huruvida sambandet är korrelativt eller orsakande är okänt, även om båda tillstånden är förknippade med dålig kost och är vanligare hos människor som lever i fattiga miljöer och med underliggande medicinska tillstånd.
Nu tyder forskning från University of Pennsylvania, i samarbete med Indiana University, att en FDA-godkänd terapi för järnbristanemi också har ett löfte för att behandla, förebygga och till och med diagnostisera tandröta. Läkemedlet, en kombination av en lösning som innehåller nanopartiklar av järnoxid som kallas ferumoxytol och väteperoxid, applicerades på riktig tandemalj placerad i en tandprotesliknande apparat och bars av försökspersonerna.
Studien, publicerad i tidskriften Nano Letters , fann att en två gånger dagligen applicering av ferumoxytol, vilken aktiverad väteperoxid som ingår i en eftersköljning, minskade avsevärt uppbyggnaden av skadligt tandplack och hade en riktad effekt på bakterierna som till stor del var ansvariga för karies. Dessa typer av nanopartiklar med enzymliknande egenskaper är ibland kända som "nanozymer" och utforskas alltmer för sin potential i biomedicinska och miljömässiga tillämpningar.
"Vi fann att detta tillvägagångssätt är både exakt och effektivt", säger Hyun (Michel) Koo, professor vid University of Pennsylvania School of Dental Medicine. "Det stör biofilmer, särskilt de som bildas av Streptococcus mutans , som orsakar karies, och det minskade också omfattningen av emaljförfall. Detta är den första studien vi känner till gjort i en klinisk miljö som visar det terapeutiska värdet av nanozymer mot en infektionssjukdom."
Verket är en förlängning av en artikel från 2018 publicerad i Nature Communications , där Koo och kollegor, inklusive David Cormode från Penns Perelman School of Medicine, visade att behandlingen av järnoxid nanopartikel-väteperoxid kunde förhindra biofilmansamling och karies i en experimentell modell och en djurmodell.
I det aktuella arbetet ville forskarna ta nästa logiska steg, att arbeta i människor. I en randomiserad studie lät de 15 deltagare använda en löstagbar, tandprotesliknande anordning med äkta tandemalj fäst, en metod som utvecklats och testats utförligt av Domenick T. Zero från Indiana University, en medförfattare på den aktuella artikeln.
Studiedeltagarna applicerade en sockerhaltig lösning på apparaten fyra gånger om dagen, efterliknade måltider och snacks med hög sockerhalt som konsumerades under det dagliga livet. Deltagarna ombads att inte borsta emaljproverna utan istället att skölja apparaten två gånger om dagen. Deltagarna delades in i tre grupper, där en använde ferumoxytol och sedan väteperoxidsköljning, en med en lösning som ger de inaktiva ingredienserna i ferumoxytol och en tredje med enbart vatten.
Efter 14 dagar analyserade forskarna biofilmerna som samlades på emaljproverna. De fann att den experimentella behandlingen kraftigt minskade tillväxten av biofilmer innehållande S. mutans och kunde döda denna bakterie med hög specificitet. Andra kommensala bakterier som normalt finns i munnen påverkades inte av ferumoxytol-väteperoxidbehandlingen.
Resultaten och säkerheten för tillvägagångssättet stöddes av tidigare arbete, som har visat att järnoxidnanopartiklarna inte binder till slemhinnevävnaden i munnen och inte orsakar cytotoxicitet eller förändringar i den orala mikrobiomet i en djurmodell.
"Denna behandling verkar inte ha skadliga effekter utanför målet", säger Koo.
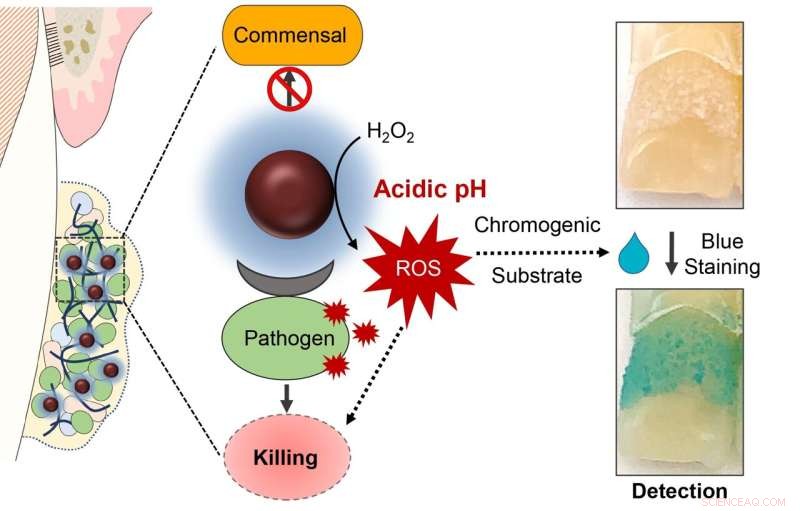
Anledningen till denna precision är trefaldig. Reaktionen för att katalysera väteperoxid sker endast i en mycket sur miljö, till exempel vad som uppstår när kariesframkallande bakterier är närvarande och aktiva. Behandlingen gör också att den klibbiga matrisen av kolhydrater bryts ner, försämrar biofilmen och exponerar mikroberna. Och ferumoxytol kan specifikt binda till receptorer på S. mutans cellmembran, vilket underlättar dess dödande.
I ett sista skede av studien lade forskarna till en markör som blir blå när den exponeras för reaktiva syrearter, som de som genereras av katalys av väteperoxid av ferumoxytol-nanopartiklar. Och faktiskt fann teamet att intensiteten av blå märkning motsvarade sura biofilmer innehållande S. mutans .
På grund av denna "detektions"-förmåga, noterar Koo att den experimentella behandlingen har potential att bli vad som kallas en "theranostic", det vill säga ett läkemedel som kan användas för att både diagnostisera ett tillstånd och behandla det. "Det kan också användas hemma," säger Koo. "Du kan skölja med det, se hur mycket hålrumsframkallande plack det finns och sedan behandla med lösningen eller konsultera en tandläkare för uppföljande behandling." + Utforska vidare