I en ny Nature Communications I studien har forskare utforskat konstruktionen av genetiska kretsar på enstaka DNA-molekyler, och demonstrerat lokaliserad proteinsyntes som en vägledande princip för dissipativa nanoenheter, vilket ger insikter i artificiell celldesign och nanobiotekniktillämpningar.
Termen "genetisk krets" är en metaforisk beskrivning av det komplexa nätverket av genetiska element (såsom gener, promotorer och regulatoriska proteiner) i en cell som interagerar för att kontrollera genuttryck och cellulära funktioner.
Inom konstgjord celldesign strävar forskare efter att replikera och konstruera dessa genetiska kretsar för att skapa funktionella, fristående enheter. Dessa kretsar fungerar som det molekylära maskineriet som ansvarar för orkestrering av cellulära processer genom att exakt reglera produktionen av proteiner och andra molekyler.
Genom att förstå och manipulera dessa kretsar kan forskare konstruera konstgjorda celler med programmerbara beteenden, som efterliknar funktionerna hos naturliga celler.
Inom ramen för den nämnda studien ligger fokus på att konstruera genetiska kretsar på enstaka DNA-molekyler. Detta representerar ett nytt tillvägagångssätt när det rör sig bort från det traditionella cellulära sammanhanget och utforskar möjligheten att skapa genetiska kretsar under cellfria förhållanden.
Första författaren Dr. Ferdinand Greiss från Weizmann Institute of Science i Israel förklarade forskarnas motivering till Phys.org:"Vi försöker rekonstruera biologiska processer utanför de komplexa kretsloppen av levande celler, och förhoppningsvis förbättra vår förståelse av naturens vägledande principer. forskning är inriktad på konstruktion av framtida artificiella celler, och enstaka DNA-molekyler kan vara den genetiska grunden för sådana."
Genreglering är den process genom vilken celler kontrollerar uttrycket av gener, som bestämmer när och i vilken utsträckning en gens information används i syntesen av funktionella molekyler som proteiner eller RNA. Det spelar en avgörande roll för att upprätthålla cellulära funktioner, reagera på miljöförändringar och säkerställa korrekt utveckling.
Regleringen av genuttryck involverar transkription och translation. Under transkription fungerar ett specifikt segment av DNA som en mall för syntes av komplementära mRNA-molekyler med RNA-polymeras. Detta mRNA bär den genetiska koden från kärnan till cytoplasman, där translation sker.
Translation innebär omvandling av mRNA till proteiner. Ribosomer läser av mRNA-sekvensen, vilket underlättar sammansättningen av aminosyror till en polypeptidkedja och bildar det protein som kodas av genen.
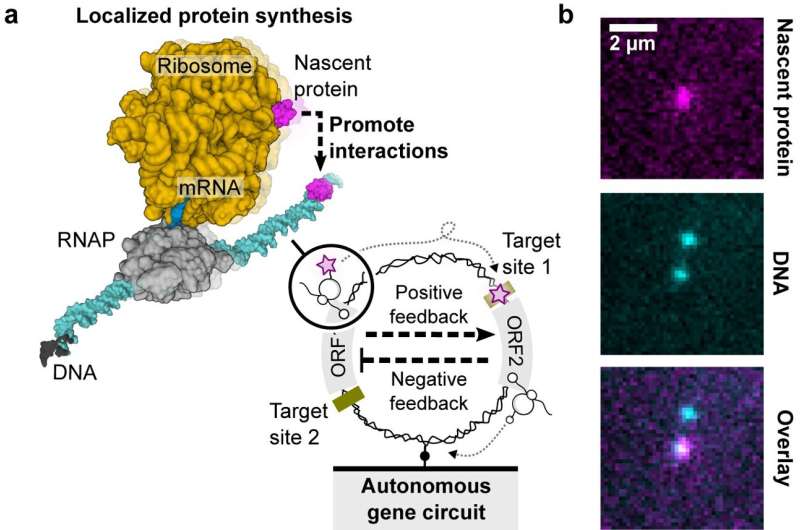
"I prokaryota system är transkriptions- och translationsprocesserna kopplade. Det betyder att när RNA-polymeraset väl producerar mRNA från DNA kan ribosomen hitta det ribosomala bindningsstället på det begynnande mRNA:t för att börja syntetisera proteinet. Det begynnande proteinet kan vikas och fungera medan det fortfarande är bundna till DNA:t av RNA-polymeras-mRNA-ribosomkomplexet Efter avslutad transkription eller translation, faller det begynnande proteinet av DNA:t och sprids i bulklösningen, "förklarade medförfattaren Dr. Shirley Shulman Daube. Weizmann Institute of Science i Israel.
Betydelsen ligger i den ökade lokala koncentrationen av nystartade proteiner, som är cirka 1 000 gånger högre än den omgivande bulklösningen. Denna rumsliga organisation och koncentrationsökning kan ha konsekvenser för cellulära funktioner och potentiellt spela en roll i konstruktionen av konstgjorda celler med enstaka DNA-molekyler.
"Genetiska kretsar är baserade på genetiskt kodade molekyler, såsom transkriptionsfaktorer, som produceras från DNA och binder tillbaka till DNA för att reglera sin egen och andra molekylers produktion", säger medförfattaren Dr. Vincent Noireaux från University of Minnesota .
För att bygga den genetiska kretsen på en enda DNA-molekyl designade forskarna specifika sekvenser med gener för lambdabakteriofag (E. coli).
Den genetiska kretsen involverade en negativ kaskad, styrd av CI-repressorgenen och dess operatörsbindningsställe, som intrikat kontrollerar HT-genen. Denna HT-gen kodade för HaloTag-proteinet (HT), ett avgörande element för att visualisera begynnande proteiner på individuella DNA-molekyler.
Studien implementerade stränga villkor, inklusive låg DNA-ytdensitet, för att säkerställa exakt lokaliserad proteinsyntes.
Samtidigt utvecklades en positiv kaskad med fusionen av T7-bakteriofag-RNA-polymeraset (HT-T7 RNAP) och HT-proteinet, vilket möjliggör realtidsövervakning av genuttryck genom en nedströms reportergen, GFP.
Ett långt rött fluorogent färgämne (MaP655-Halo) förbättrade upptäckten av nya proteiner, vilket gav en heltäckande bild av den genetiska kretsens dynamik.
Den negativa kaskaden, eller undertryckandet, reglerar och hämmar produktionen av specifika proteiner under vissa förhållanden. Å andra sidan bidrar positiva kaskader till aktiveringen och uttrycket av specifika gener inom den genetiska kretsen.
Forskningen gick utöver bara observation och inkluderade en återkopplingskrets med en syntetisk dCro-repressor. Denna komponent var avgörande för att reglera genuttryck genom en noggrant utformad syntetisk promotor.
Forskarna upptäckte att lokaliserad proteinsyntes på en enskild DNA-molekyl kan driva genetiska kretsar under cellfria förhållanden utan inneslutning av cellulära fack. Dynamiken i genetiska kretsar observerades noggrant under mycket utspädda förhållanden.
Huvudförfattaren Dr. Roy Bar-Ziv från Weizmann Institute of Science i Israel lyfte fram betydelsen av deras fynd:"Regleringen av genuttryck beror på att proteiner binder till DNA:t, blockerar eller ökar aktiviteten hos en gen. Bindningen kräver hög koncentrationer av proteiner för att hitta och binda specifika sekvenser på DNA-molekylen. Oväntat finner vi att lokaliserad proteinsyntes tillfälligt kan öka koncentrationen tillräckligt länge för att proteiner ska kunna göra detsamma utan cellulär inneslutning."
I grund och botten utmanar fyndet den konventionella uppfattningen att höga koncentrationer är avgörande för genreglering, och introducerar en ny aspekt av lokaliserad proteinsyntes som ett sätt att påverka genetiska kretsar under cellfria förhållanden.
För framtida arbete, föreställer sig forskarna att utnyttja lokaliserad proteinsyntes som en vägledande princip för att förbättra funktionaliteten hos artificiella celler konstruerade från enstaka DNA-molekyler, för att ta itu med utmaningar vid låga koncentrationer. De förutser också potentiella tillämpningar i självkodade nanoenheter och planerar att utforska sambanden mellan DNA-struktur, genuttrycksdynamik och proteinsyntes.
Forskningen involverade också bidrag från Nicolas Lardon med prof. Kai Johnsson vid MPI för medicinsk forskning, som utvecklade det fluorogena färgämnet (MaP655-Halo); Yoav Barak, som hjälpte till med att optimera DNA-preparatet; och Leonie Schütz med prof. Elmar Weinhold, som banade väg för utvecklingen av metyltransferaser för platsspecifika DNA-modifieringar med biotiner.
Mer information: Ferdinand Greiss et al, En genetisk krets på en enda DNA-molekyl som en autonom dissipativ nanoenhet, Nature Communications (2024). DOI:10.1038/s41467-024-45186-2
Journalinformation: Nature Communications
© 2024 Science X Network