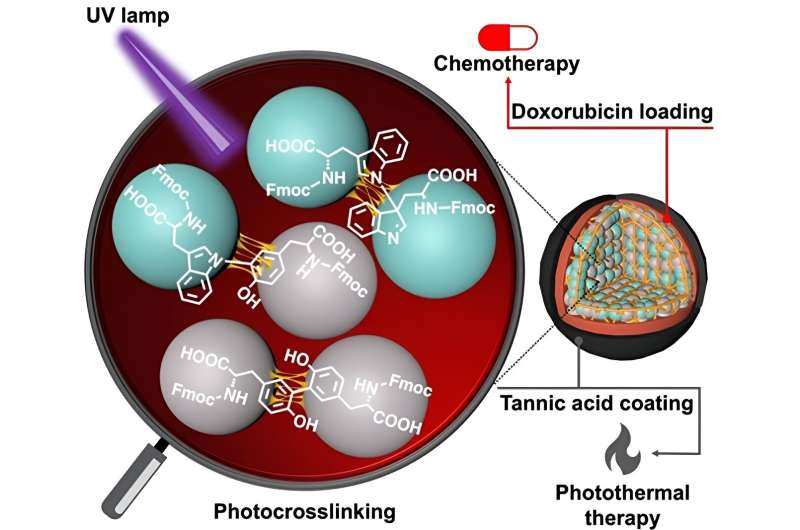
Aminosyror, såsom tyrosin och tryptofan, är de grundläggande byggstenarna som utgör proteiner. Dessa biomolekyler har olika kemiska grupper på varje ände och sidokedja, och har därför den naturliga förmågan att bilda en kedja genom bildandet av en amid (peptid) bindning. Sådana kopplingar är emellertid svaga och bryts lätt ned under fysiologiska förhållanden. Det är här de Fmoc-skyddade aminosyrorna kommer in i bilden.
I en ny studie nu, ett forskarlag ledd av Dr. Eijiro Miyako, docent, Japan Advanced Institute of Science and Technology (JAIST) och Dr. Alberto Bianco och Dr. Cécilia Ménard-Moyon från Centre National de la Recherche Scientifique ( CNRS), Frankrike, använde ultraviolett ljus vid 254 nm (som leder till CBPUV-nanopartiklar) och riboflavin-medierad tvärbindning vid 365 nm (som leder till CBPRibo-nanopartiklar) för att tvärbinda de Fmoc-skyddade aminosyrorna.
"Aminosyror som är byggstenarna i proteiner har många fördelar, såsom bättre biokompatibilitet. Därför ville vi skapa nya självmonterade aminosyrabaserade nanopartiklar som kan utlösas genom flera mekanismer", säger Dr. Eijiro Miyako. Resultaten av denna studie publiceras i Small .
De självmonterade aminosyrorna var stabilt tvärbundna dimerer av Fmoc-Tyr-OH (tyrosin) och Fmoc-Trp-OH (tryptofan). Doxorubicin, ett läkemedel mot cancer, laddades därefter in i de tvärbundna aminosyrananopartiklarna.
För att öka stabiliteten hos nanopartiklarna använde forskarna ett garvsyra-järn (Fe 3+ ) komplex (eller TAF) som det yttre lagret av beläggning. Denna beläggning kan brytas ned inuti cellerna genom den enzymatiska glutationfrisättningen eller genom pH-skillnad i tumörens mikromiljö. Garvsyrabeläggningen kan också användas i fototermisk anticancerterapi, där externt ljus kan öka den lokala temperaturen som omger cancervävnaden och orsaka cancercelldöd.
De syntetiserade nanopartiklarna studerades sedan omfattande för deras strukturella integritet, stabilitet och läkemedelsfrisättning under olika pH-förhållanden. Den funktionella profilen, cellupptaget och biokompatibiliteten hos självmonterade aminosyrananopartiklar studerades sedan med hjälp av cellodlingstekniker.
Slutligen analyserades anticancereffektiviteten hos syntetiserade nanopartiklar i tumörbärande möss. Den kombinerade metoden för kemoterapi, på grund av doxorubicinverkan, och fototermisk terapi tack vare garvsyrabeläggningen, visade utmärkt anticanceraktivitet.
Efter tvärbindning visade de aminosyrabaserade nanopartiklarna anmärkningsvärda förändringar i färg, storlek, absorbans, fluorescens och termisk stabilitet. Dessutom uppvisade CBPUV överlägsen stabilitet efter tvärbindning, jämfört med CBPRibo. CBPUV bibehöll också konsekvent sin struktur, medan CBPRibo visade partiell demontering och bildade ihåliga sfärer.
Studie av läkemedelsfrisättning avslöjade minimal läkemedelsfrisättning under fysiologiskt pH (7,4), vilket indikerar att stabil beläggning är avgörande för in vivo-tillförsel. Vid pH 5,5 resulterade ofullständig beläggningsnedbrytning i försumbar läkemedelsfrisättning. Men tillsatsen av glutation (GSH) vid pH 5,5 ökade läkemedelsfrisättningen avsevärt genom att utlösa nedbrytning av TAF-beläggning, vilket indikerar GSH/pH-känslighet.
Den kombinerade sura och GSH-behandlingen intensifierade beläggningsnedbrytningen. Detta lyhörda beteende möjliggör kontrollerad läkemedelsfrisättning under specifika fysiologiska förhållanden. Vidare visade in vitro-bedömningar koncentrationsberoende cytotoxicitet och förbättrad effekt vid kombinerad kemo-/fototermisk behandling. In vivo-studier på tumörbärande möss visade på betydande tumörtillväxthämning, vilket tyder på lovande anticancereffekter utan observerade biverkningar.
Dr. Miyako sa:"Nanoteknik lovar att omvandla grundläggande laboratorievetenskap till ett kraftfullt verktyg för att bekämpa komplexa sjukdomar som cancer. Vi är optimistiska att denna banbrytande forskning kommer att gå framåt och potentiellt utvecklas till banbrytande cancerbehandlingsteknologi redo för kliniska prövningar inom tio år."
I fortsättningen kan utvecklingen av dessa självmonterade aminosyrananopartiklar hjälpa till att bekämpa kritiska problem som multi-läkemedelsresistens vid cancer och förbättra den övergripande effekten av behandlingsresultat.
Mer information: Tengfei Wang et al, Photocrosslinked Co-Assembled Amino Acid Nanoptics for Controlled Chemo/Phototermal Combined Anticancer Therapy, Small (2023). DOI:10.1002/smll.202307337
Journalinformation: Liten
Tillhandahålls av Japan Advanced Institute of Science and Technology