Blod-hjärnbarriären blockerar inträdet av antikroppar i hjärnan. Detta begränsar den potentiella användningen av antikroppsläkemedel för att behandla hjärnsjukdomar, såsom hjärntumörer.
På andra ställen i kroppen används mer än 100 amerikanska Food and Drug Administration-godkända terapeutiska antikroppar av medicinska team för att behandla cancer och autoimmuna, infektionssjukdomar och metabola sjukdomar. Att hitta sätt att transportera terapeutiska antikroppar över blod-hjärnbarriären – från den perifera blodströmmen till centrala nervsystemet – kan skapa effektiva behandlingar som verkar i hjärnan.
I en ny studie publicerad i tidskriften Frontiers in Cell and Developmental Biology , rapporterar forskare vid University of Alabama i Birmingham att den platsstyrda tillsatsen av en FDA-godkänd, biologiskt nedbrytbar polymer vid gångjärns- och nära gångjärnsregionerna av den terapeutiska antikroppen trastuzumab effektivt underlättade hjärnavgivningen av denna humana monoklonala IgG1-antikropp. Trastuzumab används för att behandla bröstcancer och flera andra cancerformer.
Preliminärt arbete på denna nya plattform inkluderade in vitro- och musmodellexperiment. Forskare säger att leveranssystemet fortfarande måste optimeras och testas ytterligare, men notera att deras enkla metodik omvandlar antikroppsterapi till en form som kan levereras av hjärnan som upprätthåller antikroppens medicinska funktionalitet.
"Bekymmer med hjärninträde förföljer utvecklingen av antikroppsterapier som riktar sig mot hjärnsjukdomar, vilket hindrar medicinska översättningar av laboratoriegenererade antikroppar till klinisk praxis", säger Masakazu Kamata, Ph.D., ledare för studien och docent. vid UAB Institutionen för mikrobiologi. "I detta sammanhang har denna enkla metod stor potential att fungera som plattformen för att inte bara återanvända den nuvarande antikroppsterapin, utan också uppmuntra designen av nya antikroppar för behandling av hjärnsjukdomar."
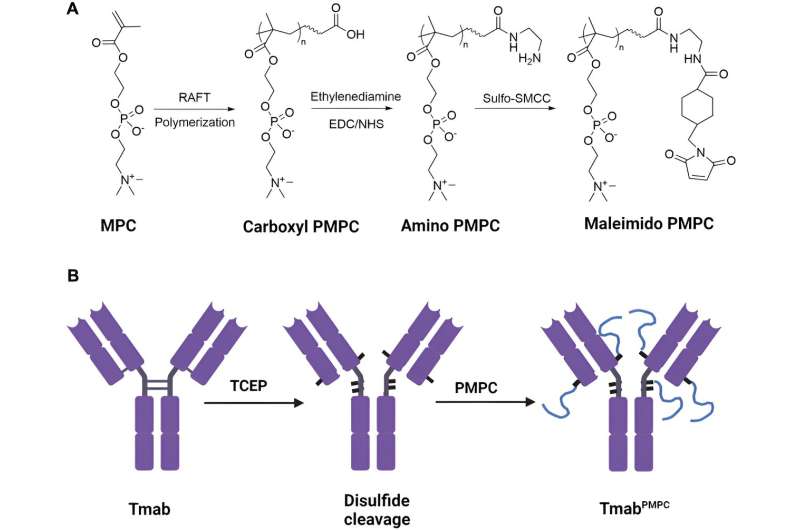
Den biokompatibla polymeren som användes var poly-2-metakryloyloxietylfosforylkolin, eller PMPC, med kedjelängder på 50, 100 eller 200 monomerer. Forskarna hade redan upptäckt att denna icke-immunogena polymer, som FDA har godkänt som beläggningsmaterial för transplanterbara enheter, kunde binda till två receptorer på hjärnans mikrovaskulära endotelceller som utgör blod-hjärnbarriären, och dessa celler kan sedan flytta polymeren. över blod-hjärnbarriären genom transcytos. Transcytos är en specialiserad transport där extracellulär last förs in i cellen, skjuts över cytoplasman till andra sidan av cellen och sedan frigörs.
UAB-forskarna kunde klyva fyra disulfidbindningar mellan kedjorna i trastuzumab IgG1-gångjärnsregionerna och nära gångjärnsregionerna, vilket skapade tiolgrupper. Varje tiolgrupp konjugerades sedan till en kedja av PMPC för att skapa trastuzumab-molekyler med en av de tre kedjelängderna, som de betecknade som Tmab-PMPC50, Tmab-PMPC100 och Tmab-PMPC200.
Var och en av dessa modifierade antikroppar bibehöll fortfarande trastuzumab-specifik bindning till celler som uttrycker HER2-antigenet, målet för trastuzumab. Både Tmab-PMPC50 och Tmab-PMPC100 internaliserades i HER2-positiva celler och främjade antikroppsberoende celldöd, vilket är den medicinska funktion genom vilken trastuzumab dödar HER2+ bröstcancerceller.
Forskarna visade sedan att PMPC-konjugering av trastuzumab förbättrade blod-hjärnbarriärens penetration genom epitelcellerna på blod-hjärnbarriären via transcytosvägen. Den translokerbara Tmab-PMPC100 var bäst på effektiv penetrering av blod-hjärnbarriären samtidigt som den bibehöll trastuzumabs epitopigenkänning, antikroppens förmåga att binda till sitt antigenmål.
I en musmodell var både Tmab-PMPC100 och Tmab-PMPC200 ungefär fem gånger bättre på hjärnpenetration än naturligt trastuzumab. I preliminära in vitro- och musmodellexperiment inducerade det polymermodifierade trastuzumab inte neurotoxicitet, visade inga negativa effekter i levern och störde inte blod-hjärnbarriärens integritet.
"Dessa fynd tyder sammantaget på att PMPC-konjugering åstadkommer effektiv hjärntillförsel av terapeutiska antikroppar, såsom trastuzumab, utan induktion av negativa effekter, åtminstone i levern, blod-hjärnbarriären eller hjärnan," sa Kamata.
Andra har också undersökt sätt att få last som antikroppar över blod-hjärnbarriären, noterade forskarna.
I arbetet som ledde till den aktuella studien hade UAB-forskarna för den aktuella studien visat att de kunde linda in olika makromolekylära laster i PMPC-skal, och dessa nanokapslar visade förlängd blodcirkulation, minskad immunogenicitet och förbättrad hjärnleverans hos möss och icke-mänskliga primater.
Ändå hade detta system nackdelar. Nanokapslarna krävde tillägg av målsökande ligander för att föra dem till deras sjukdomsmål och nedbrytbara tvärbindare som skulle tillåta frisättning av lasten på den platsen. Tyvärr saknar sjukdomsassocierade mikromiljöer ofta förhållanden som kan utlösa nedbrytning av tvärbindarna.
Andra forskare som försöker bryta blod-hjärnbarriären har undersökt olika ligander andra än PMPC för att öka transporten, såsom ligander som härrör från mikrober och toxiner, eller endogena proteiner som lipoproteiner. Dessa har i allmänhet haft oönskade ytegenskaper - såsom att de är mycket immunogena, mycket hydrofoba eller laddade. PMPC uppvisar inte dessa oönskade egenskaper.
Medförfattare tillsammans med Kamata i studien, "Site-oriented conjugation of poly(2-methacryloyloxyethyl phosphorylcholine) for enhanced brain delivery of antibody," är Jie Ren, Chloe E. Jepson, Charles J. Kuhlmann, Stella Uloma Azolibe och Madison T . Blucas, UAB Institutionen för mikrobiologi; Sarah L. Nealy och Eugenia Kharlampieva, UAB Institutionen för kemi; Satoru Osuka, UAB Institutionen för neurokirurgi; och Yoshiko Nagaoka-Kamata, UAB Department of Pathology.
Mer information: Jie Ren et al, Platsorienterad konjugation av poly(2-metakryloyloxietylfosforylkolin) för förbättrad hjärnleverans av antikroppar, Frontiers in Cell and Developmental Biology (2023). DOI:10.3389/fcell.2023.1214118
Tillhandahålls av University of Alabama i Birmingham