Nyligen utvecklade teamet av akademiker Huang Wei, professor Li Lin och professor Hu Wen Bo från School of Northwestern Polytechnical University ett ultraeffektivt NIR-II fototermiskt medel för 1 064 nm lasermedierad fototermisk behandling av osteosarkom.
Studien "Acceptor Engineering Produces Ultrafast Non-radiative Decay in NIR-II Aza-BODIPY Nanoptics for Efficiency Use. Osteosarcoma Photothermal Therapy via Concurrent Apoptosis and Pyroptosis", publicerades i Research .
Cancerbehandling är fortfarande en av de största utmaningarna som människor står inför idag, trots avsevärt bättre medicinsk teknik. Under de senaste åren har utvecklingen av nära-infraröda (NIR) fototermiska medel (PAT), som är molekylärt riktade läkemedel för fototermisk terapi (PTT), dykt upp som en ny forskningshotspot.
Jämfört med andra ljusband har NIR-ljus bättre biologisk penetrationsförmåga och kan användas för mild PTT av djup vävnad när det kombineras med lämpliga PAT. Majoriteten av mössmodellexperiment är fortfarande i det subkutana tumörterapistadiet, vilket begränsas av det grunda penetrationsdjupet av NIR-I-ljus och inte kan avlägsna djup tumörvävnad i kroppen.
NIR-II-ljusets penetrationsdjup ökar dock och den djupa tumör-PTT förväntas uppnå klinisk tillämpning. För närvarande finns det många studier på PTA, och olika nya material utvecklas ofta. De faktorer som påverkar funktionen hos PTA inkluderar absorptionsvåglängd, storlek och ytmodifiering.
Även om olika typer av PTA uppvisar unika fördelar, behöver ett fototermiskt material som integrerar många fördelar såsom hög fototermisk omvandlingseffektivitet (PCE), lång absorptionsvåglängd, stark biosäkerhet och god vattenlöslighet utforskas.
Småmolekylära PTA med intensiv NIR-II-absorption och höga PCEs är lovande kandidater för behandling av djupt sittande tumörer såsom osteosarkom. Hittills har utvecklingen av småmolekylära NIR-II PTA till stor del förlitat sig på tillverkning av donator-acceptor-donator (D-A-D/D') strukturer och begränsad framgång har uppnåtts.
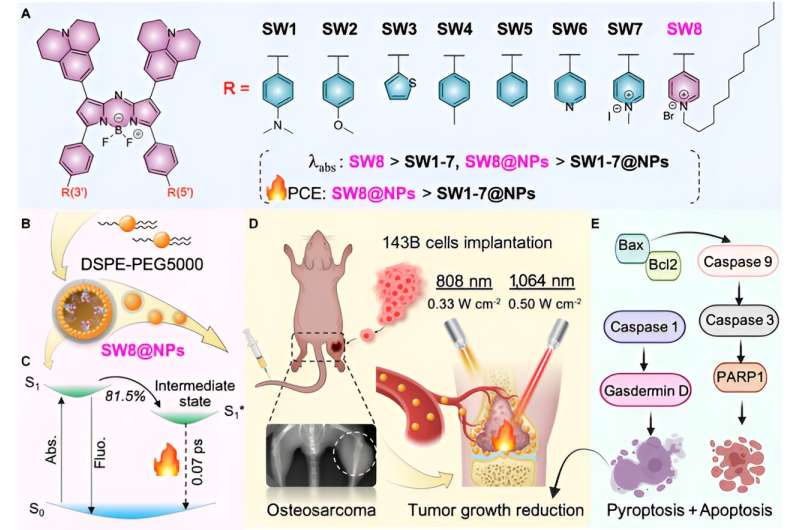
Häri, genom acceptorteknik, utvecklades en donator-acceptor-acceptor (D-A-A')-strukturerad NIR-II aza-bor-dipyrrometen (aza-BODIPY) PTA (SW8) lätt för den 1 064 nm lasermedierade fototeranostiken behandling av osteosarkom.
Att ändra givargrupperna till acceptorgrupper gav anmärkningsvärda röda förskjutningar av absorptionsmaximum från NIR-I-regioner (~808 nm) till NIR-II (~1 064 nm) för aza-BODIPYs (SW1 till SW8). Dessutom självmonterade SW8 till nanopartiklar (SW8@NPs) med intensiv NIR-II-absorption och en ultrahög PCE (75 %, 1 064 nm).
Denna ultrahöga PCE härrörde i första hand från en ytterligare icke-strålningsväg, som visade en 100-faldigt ökad sönderfallshastighet jämfört med den som visades av konventionella vägar såsom intern omvandling och vibrationsavslappning. Så småningom utförde SW8@NP:er mycket effektiv 1 064 nm lasermedierad NIR-II PTT av osteosarkom via samtidig apoptos och pyroptos.
Detta arbete illustrerar inte bara ett avlägset tillvägagångssätt för behandling av djupt sittande tumörer med hög spatiotemporal kontroll, utan tillhandahåller också en ny strategi för att bygga högpresterande småmolekylära NIR-II PTA.
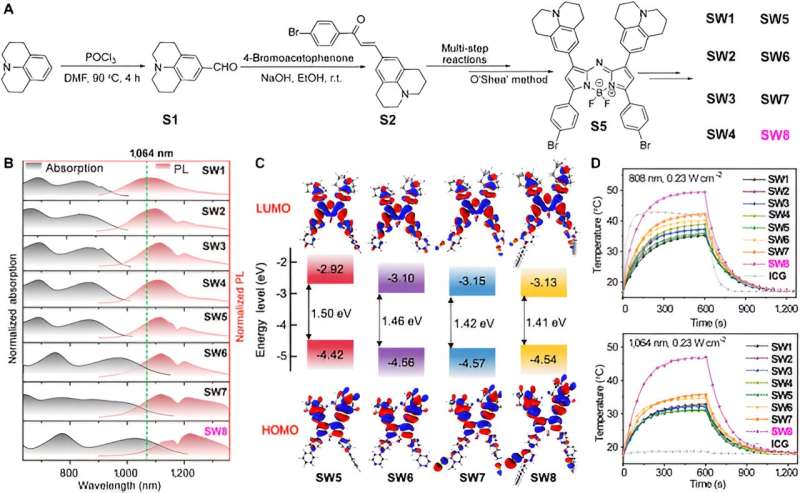
Först syntetiserade forskarna en serie organiska småmolekylära PTA-baserade aza-BODIPY. Anmärkningsvärda rödförskjutningar för absorptions- och PL-spektra inträffade från SW5 till SW6, där den elektrondonerande bensendonatorn (D') ändrades till pyridinacceptorn (A').
Ytterligare ökning av elektronbristen hos A' orsakade fler badokroma våglängder från SW6 till SW8, speciellt den röda förskjutningen av absorptionsvåglängden är uppenbar, medan den elektrondonerande delen (från SW1 till SW5) inte uppvisade någon uttalad våglängdsförskjutning. Dessutom förbättrade introduktionen av alkylkedjor J-aggregationen av molekyler, vilket manifesteras av en röd förskjutning av emissionsvåglängden från SW6 till SW8. Beräkningar av tidsberoende densitetsfunktionsteori (TD-DFT) avslöjade en gradvis minskning av HOMO-LUMO energigapet från SW5 till SW8, i överensstämmelse med de rödskiftade spektra.
Noterbart minskade LUMO-energinivåerna för SW5–8 i ordning, medan HOMO-energinivåerna var nästan oförändrade. Detta fenomen indikerar att acceptorsegmenten vid 3- och 5-positionerna av aza-BODIPY avsevärt minskade energiklyftorna, vilket erbjuder ett alternativt tillvägagångssätt för att konstruera nya organiska småmolekylära NIR-II-material.
Sedan väljer denna artikel den mest fördelaktiga absorptions-/emissionsvåglängden SW8 för självmontering. SW8 kapslades in i en amfifil matris för att bilda vattenlösliga nanopartiklar (SW8@NPs). PCE för SW8@NPs under 1 064 nm laserbestrålning fastställdes vara så hög som 75 %, vilket är en anmärkningsvärd förbättring jämfört med SW1-7@NPs.
Dessutom tillskrev ultrasnabba spektroskopiska studier denna ultrahöga PCE till ett icke-strålande mellantillstånd. Denna mörka mellanprodukt utarmade upp till 80 % av den upphetsade befolkningen med en hög sönderfallshastighet på 1,3 × 10 13 s -1 över konventionella icke-strålande sönderfallskanaler såsom intern konvertering, vilket resulterar i ultrahög PCE.
Slutligen, för att studera biokompatibiliteten hos SW8@NPs, behandlades osteosarkomcell 143B med SW8@NPs. Resultaten visade att SW8@NPs effektivt kunde ta upp cellulärt av 143B-cellerna med låg mörktoxicitet och hög fototoxicitet. Apoptosnivån ökade signifikant efter 808 nm och 1 064 fototermiska bilder togs. Röntgenbilder användes för att övervaka ortotopisk tumörtillväxt. tumörerna bestrålades med laser i 10 minuter och upprepades varannan dag i 12 dagar.
Kurvan för volymtendensen för gruppen "SW8@NPs +1 064 nm laser" visade fullständig tumörutrotning under de 12 dagarna av övervakning. Däremot misslyckades de andra fem behandlingarna att undertrycka tumörtillväxt, med en genomsnittlig ökning av tumörvolymen på 4- till 5-faldig nm laserbestrålning. Jämfört med 808 nm laser kan 1 064 nn laser penetrera 15 mm tjock muskelvävnad, effektivt stimulera SW8@NPs värmeproduktion. Ytterligare studier ortotopiska 143B-tumörbärande möss visade att SW8@NPs hade hög ackumulering och stark fototermisk effekt på tumörstället. Kontinuerlig bestrålning av tumörregioner i 10 minuter med en 808 (0,33 W cm -2 ) eller 1 064 nm laser (0,5 W cm -2 ) utfördes 24 timmar efter SW8@NPs-injektion.
Dessutom visade histologi och immunhistokemiska analyser att tumörstrukturen i gruppen "SW8@NPs+1 064 nm" var allvarligt skadad, och parenkymcellerna försvann i stort antal och verkade vakuolära, och TUNEL-resultaten visade att nivån av apoptos var signifikant ökade. Western blotting användes för att analysera apoptos-associerade proteiner (Bax, Bcl2, Caspase 9, Caspase 3 och PARP1).
I gruppen "SW8@NPs+1 064 nm" ökades den totala fosforyleringsnivån av apoptotiskt protein och apoptos aktiverades bestrålning. Tillsammans avslöjade resultaten, för första gången, att den SW8@NPs-medierade NIR-II PTT utövade antitumöreffekter främst genom att stimulera samtidig apoptos och pyroptos.
I denna studie rapporterade de om designen av en ny organisk liten molekyl PTA (SW8) och självtillgänglighetsnanopartiklar (SW8@NPs) med en hög PCE (75%) i NIR-II-fönstret (1 064 nm). Molekylära exciterade tillståndsdynamikanalyser visade att denna ultrahöga PCE främst härrörde från en ytterligare icke-strålningsväg.
En serie experiment in vitro och in vivo visade för första gången att överlägsen NIR-II PTT effektivt kunde inducera samtidig apoptos och pyroptos i osteosarkomvävnader. Forskarna föreslår att utformningen av organiska småmolekylära PTA:er baserade på rationella principer i NIR-II-fönstret kommer att gynna de praktiska kliniska tillämpningarna av fototermiska aktiveringar och behandlingar i framtiden.
Mer information: Zhenxiong Shi et al, Acceptor Engineering producerar ultrasnabb icke-strålningsförfall i NIR-II Aza-BODIPY nanopartiklar för effektiv osteosarkom fototermisk terapi via samtidig apoptos och pyroptos, Forskning (2023). DOI:10.34133/research.0169
Journalinformation: Forskning
Tillhandahålls av Research