Ett nytt sätt att se detaljer som är mindre än halva ljusets våglängd har avslöjat hur nanoskala byggnadsställningar inuti celler bryggar till makroskalan under celldelning. Till skillnad från tidigare superupplösningstekniker, är den som utvecklats och testades vid University of Michigan inte beroende av molekyler som slits ut vid långvarig användning.
Superupplösning kan avslöja strukturer ner till 10 nanometer, eller ungefär samma bredd som 100 atomer. Det öppnade en helt ny värld inom biologi, och teknikerna som först gjorde det möjligt fick ett Nobelpris 2014. Dess svaghet är dock att den bara kan ta ögonblicksbilder över tiotals sekunder. Detta gör det omöjligt att observera utvecklingen av en cells maskineri under långa tidsperioder.
"Vi undrade - när systemet som helhet delar sig, hur interagerar strukturer i nanometerskala med sina grannar på nanometerskalan, och hur skalar denna interaktion upp till hela cellen?" frågade Somin Lee, UM biträdande professor i el- och datateknik, som ledde studien publicerad i Nature Communications .
För att svara på den frågan behövde Lee och kollegor en ny typ av superupplösning. Med sin nya metod kunde de kontinuerligt övervaka en cell i 250 timmar.
"Den levande cellen är en hektisk plats med proteiner som myllrar här och där. Vår superupplösning är mycket attraktiv för att se dessa dynamiska aktiviteter", säger Guangjie Cui, en Ph.D. student i elektro- och datateknik och medförfattare till studien tillsammans med Yunbo Liu, en Ph.D. examen i el- och datateknik.
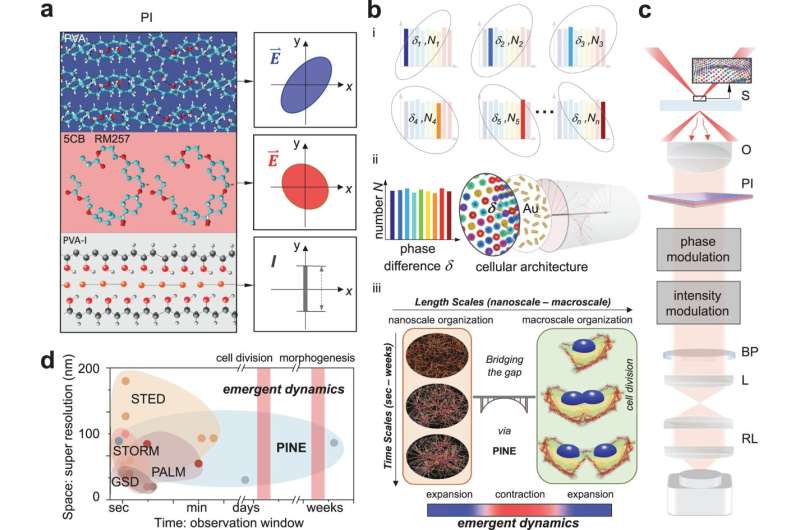
Liksom den ursprungliga metoden använder den nya tekniken sonder nära de intressanta föremålen i nanoskala för att belysa dem. Superresolution 1.0 använde fluoroforer för detta, fluorescerande molekyler som skulle skicka ut ett svarsljus efter att ha blivit belysta. Om fluoroforerna var närmare varandra än storleken på det som avbildades, skulle bilden kunna rekonstrueras från ljusskurarna som produceras av fluoroforerna.
Den nya tekniken använder guld nanorods, som inte bryts ner vid upprepad exponering för ljus, men att använda ljuset som interagerar med dem är mer utmanande. Nanorods reagerar på ljusets fas, eller var det är i upp-och-nedsvängningen av de elektriska och magnetiska fält som utgör det. Denna interaktion beror på hur nanorroden är vinklad mot det inkommande ljuset.
Liksom fluoroforerna kan nanoroderna fästa vid speciella cellstrukturer med målmolekyler på sina ytor. I det här fallet sökte nanoroderna upp aktin, ett protein som lägger till struktur till mjuka celler. Aktin är format som förgrenade filament, var och en cirka 7 nanometer (miljondelar av en millimeter) i diameter, även om de länkar samman för att sträcka sig över tusentals nanometer. Även om nanoroderna ofta är mer än dubbelt så stora som aktinets diameter, kan data som de tillhandahåller som grupp belysa dess små detaljer.
För att lokalisera nanoroderna byggde teamet filter gjorda av tunna lager av polymerer och flytande kristaller. Dessa filter möjliggjorde detektering av ljus med en viss fas, vilket gjorde det möjligt för teamet att välja ut nanorods med speciella vinklar mot det inkommande ljuset. Genom att ta 10–30 bilder – var och en tittar på en annan delmängd av nanorods – och slå samman dem till en enda bild, kunde teamet härleda detaljerna i nanometerskala för filamenten inuti cellerna. Dessa detaljer skulle suddas ut i konventionella mikroskop.
Med hjälp av tekniken upptäckte teamet tre regler som styr hur aktin självorganiserar sig under celldelning:
Aktinets beteende är kopplat till cellens beteende - men cellen drar ihop sig när aktinet expanderar och det expanderar när aktinet drar ihop sig. Teamet vill utforska detta ytterligare och upptäcka varför rörelserna är motsatta i olika skalor. De vill också undersöka konsekvenserna av att oreglera denna molekylära process:Är detta roten till vissa sjukdomar?
Mer allmänt hoppas de kunna använda superupplösning för att förstå hur självorganisering är inbyggd i biologiska strukturer, utan behov av central kontroll.
"Vår genetiska kod innehåller faktiskt inte tillräckligt med information för att koda varje detalj i organisationsprocessen," sa Lee. "Vi vill utforska mekanismerna för kollektiva beteenden utan central koordination som är som fåglar som flyger i formation - där systemet drivs av interaktioner mellan enskilda delar."
Mer information: Guangjie Cui et al, Phase intensity nanoscope (PINE) öppnar långtidsundersökningsfönster av levande materia, Nature Communications (2023). DOI:10.1038/s41467-023-39624-w
Journalinformation: Nature Communications
Tillhandahålls av University of Michigan