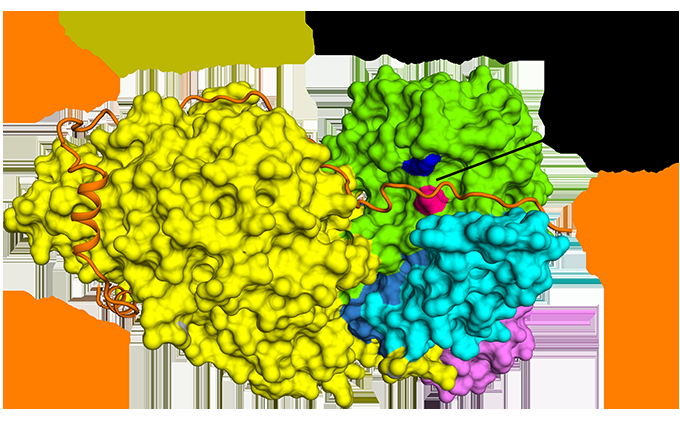
Figur 1:Antiparallell bindning av securin jämfört med separas. Upphovsman:Diamond Light Source
Strukturen för ett viktigt proteinkomplex som reglerar metafas-till-anafasövergången under cellcykelprogression har lösts med hjälp av kryo-elektronmikroskopi (cryo-EM) vid Diamond Light Source. Strukturstudien, detaljerad i Naturens strukturella och molekylära biologi , har gett värdefull inblick i det inre arbetet i separase -securin -komplexet.
Separas är ett enzym som är ansvarigt för klyvning av kleisinunderenheterna (Scc1 och Rec8) i kohesinringen som håller samman systerkromatider under mitos. När kromatiderna frigjorts genom separering, de segregerar mot motsatta poler i cellen, redo att bilda nya kärnor i två identiska dotterceller. Separas hålls i schack av en inhiberande chaperon som kallas securin, som på ett intressant sätt också antas ha aktiverande egenskaper.
Även om det upptäcktes för nästan 20 år sedan, det är först nyligen som strukturen för separas bunden till securin har belysts. Cryo-EM genomfördes vid Electron Bio-Imaging Center (eBIC) på Diamond för att bestämma strukturen för hela komplexet och för att utforska den molekylära interaktionen mellan separas och securin. Det upptäcktes att securin bildar en utökad konformation för att interagera längs hela längden av separas, och hämmar enzymet genom en pseudosubstratmekanism på det aktiva stället. En fullständig förståelse för denna interaktion och cellcykelkontrollens karaktär kan öppna nya vägar för riktad läkemedelsdesign.
Ett cellcykelregleringskomplex
När kromosomer replikeras innehåller de båda två systerkromatider, och under celldelning måste dessa kromatider separeras på ett koordinerat och exakt sätt för att producera två identiska dotterkärnor. I början av mitos, systerkromatiderna hålls samman av ett proteinkomplex som kallas kohesin; dock, under metafas-till-anafasövergången klyvs kohesinet av ett proteasenzym som kallas separas för att separera kromatiderna och låta dem röra sig till motsatta sidor av cellen precis innan den delar sig.
Övergången av metafas till anafas börjar när ett stort multi-subenhet E3 ubiquitin ligas, kallas anafasfrämjande komplex (eller APC/C) markerar en hämmande chaperon, kallas securin, med ubiquitin för förstörelse. När securin förstörts, separas är fritt att klyva kohesin och separera kromatiderna.
Separas -securinkomplexet är avgörande för celldelning, men strukturen för denna duo hade inte lösts i sin helhet. Dr Andreas Boland, Postdoktor i Dr David Barfords grupp vid MRC Laboratory of Molecular Biology och medledare av studien förklarade varför detta komplex är så fascinerande:"Fel segregering av genetiskt material kan leda till aneuploidi och tumörgenes, därför är detta ett av de viktigaste stegen under cellcykelprogression. Paradoxalt, securin förhindrar inte bara för tidig klyvning av kohesin, men det kan också främja separasaktivitet. För att förstå de dubbla mekanismerna för aktivering och förtryck i detalj använde vi kryo-EM med en partikel. "
Cryo-EM-struktur med 3,8 Å-upplösning
Separas -securin -komplex från både C. elegans och människor uttrycktes, renat, och appliceras på grafenoxid-täckta guldkolnät innan de fryses i flytande etan. Cryo-EM-mikroskop samlades in med Titan Krios-mikroskopet på eBIC med en kalibrerad förstoring av 47, 619, vilket motsvarade en pixelstorlek på 1,05 Å.
Dr Boland noterade värdet av cryo-EM för denna applikation:"Proteinkomplexen är relativt små i storlek, med mindre än 250 kDa för människan och bara cirka 150 kDa för C. elegans -komplexet, men de innehåller flera domäner och är flexibla, så de var utmanande material att kristallisera. Cryo-EM är ett genomförbart alternativ även för små proteinkomplex som detta. "
För första gången någonsin, cryo-EM användes för att bestämma strukturen nära atomupplösning av C. elegans separase-securin-komplexet. Vidare, strukturen för den mänskliga ekvivalenten av komplexet löstes till medellös upplösning, avslöjar det evolutionära bevarandet av separas triangulära form.
Cryo-EM tillät laget att visualisera hur securin engagerar sig i separas. Den antar en utökad antiparallell konformation för att binda till hydrofoba fläckar längs hela längden av separas. Nyfiket, dessa hydrofoba interaktioner visade sig också stabilisera separas, potentiellt förklarar de aktiverande effekterna av securin på separas. Dessutom, securin interagerar med det katalytiska stället för separas via en pseudosubstratmekanism. En argininrest som är närvarande vid P1 -klyvningsläget i kohesinsubstraten Sccl och Rec8 ersätts i securin med en hydrofob rest. Denna substitution är ansvarig för att förvränga geometri för separaskatalytiska stället vid substratklyvningsläget, blockerar följaktligen dess proteasaktivitet.
Separas är avgörande för cellcykelprogression, så det kan vara ett intressant läkemedelsmål. Mutationer, överuttryck, och misslokalisering av separas har visat sig vara associerat med tumörutveckling såsom bröstcancer.
Dr Boland planerar att fortsätta studera komplexet:"I framtiden, vi vill förbättra upplösningen av det mänskliga separas-securinkomplexet för att uppnå en atom- eller nära atomupplösning. Vi skulle också vilja förstå hur separas-securinkomplexet är bundet och ubiquitinerat av APC/C för att markera det för förstörelse, så vi kommer att fortsätta använda cryo-EM för detta ändamål. "