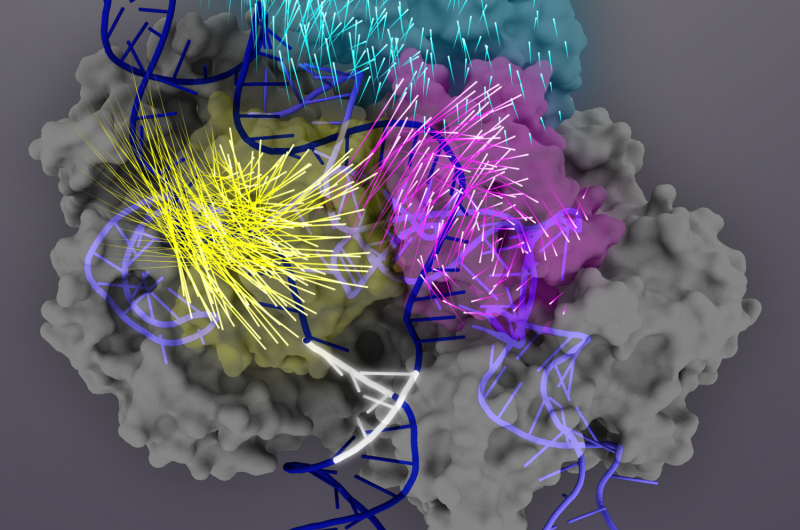
Cas9-proteinet (grå) är ett RNA-styrt nukleas som kan programmeras för att binda och klippa vilken matchande DNA-sekvens som helst (mörkblå dubbelhelix), vilket gör det till ett kraftfullt verktyg för genomteknik. Vid målbindning, Cas9-proteindomäner genomgår konformationella omarrangemang (rörelserna hos individuella aminosyror representeras av raketsvansar) för att aktivera Cas9-sgRNA-komplexet för målklyvning. REC3-domänen (teal) är ansvarig för målavkänning, som signalerar utåtrotation av REC2-domänen (magenta) för att öppna en väg för HNH-nukleasdomänen (gul). Denna aktiva konformation av Cas9 är sedan kapabel att utlösa samordnad klyvning av båda strängarna av mål-DNA. Kredit:Janet Iwasa grafik för Doudna Lab
Forskare vid University of California, Berkeley och Massachusetts General Hospital har identifierat en nyckelregion inom Cas9-proteinet som styr hur exakt CRISPR-Cas9 kommer in på en mål-DNA-sekvens, och har justerat den för att producera en hyperexakt genredigerare med den lägsta nivån av skärning utanför målet hittills.
Proteindomänen som forskarna identifierade som en mastercontroller för DNA-skärning är ett uppenbart mål för omkonstruktion för att förbättra noggrannheten ytterligare, säger forskarna. Detta tillvägagångssätt borde hjälpa forskare att anpassa varianter av Cas9 - proteinet som binder och skär DNA - för att minimera risken för att CRISPR-Cas9 kommer att redigera DNA på fel plats, en viktig faktor när man gör genterapi på människor.
En strategi för att uppnå förbättrad noggrannhet är att skapa mutationer i den styrande proteindomänen, kallas REC3, och se vilka som förbättrar noggrannheten utan att påverka effektiviteten av skärning på målet.
"Vi har funnit att även mindre ändringar i REC3-domänen för Cas9 påverkar skillnaden mellan redigering på och utanför målet, vilket tyder på att denna domän är en uppenbar kandidat för djupgående mutagenes för att förbättra inriktningsspecificiteten. Som en förlängning av detta arbete, man skulle kunna utföra en mer opartisk mutagenes inom REC3 än de riktade mutationer vi har gjort, " sa medförfattaren Janice Chen, en doktorand i Jennifer Doudnas labb, som var med och uppfann genredigeringsverktyget CRISPR-Cas9.
Medförfattarna Chen, Yavuz Dagdas och Benjamin Kleinstiver, och deras kollegor vid UC Berkeley, Massachusetts General Hospital och Harvard University rapporterar sina resultat online idag innan de publiceras i tidskriften Natur .
Hyperexakt Cas9
Sedan 2012, när Doudna, en professor i molekylär- och cellbiologi och en utredare vid Howard Hughes Medical Institute vid UC Berkeley, och kollega Emmanuelle Charpentier vid Max Planck Institute for Infection Biology använde om Cas9-proteinet för att skapa ett billigt, exakt och lättanvänd genredigerare, forskare har försökt minska risken för redigering utanför målet. Medan förbättrad trohet gynnar grundforskning, det är helt avgörande när man redigerar gener för kliniska tillämpningar, eftersom all DNA-skärning utanför målet kan inaktivera nyckelgener och leda till permanent, oväntade biverkningar.
Under de senaste två åren, två team konstruerade mycket exakta Cas9-proteiner - en förstärkt specificitet som kallas eSpCas9(1.1) och en högtrohet som heter SpCas9-HF1 - och Chen och Doudna försökte lära sig varför de skär med högre specificitet än vildtyps-Cas9-proteinet från Streptococcus pyogener som används i stor utsträckning idag.
För närvarande, forskare som använder CRISPR-Cas9 skapar ett single-guide RNA (sgRNA) - en RNA-molekyl som inkluderar en kedja av 20 ribonukleinsyror som kompletterar en specifik 20-nukleinsyror DNA-sekvens som de vill rikta in sig på - och fäster den till Cas9. Detta guide-RNA låter Cas9 komma in på det komplementära DNA:t, bind till den och skär den dubbelsträngade helixen. Men Cas9-sgRNA-komplexet kan också binda till DNA som inte exakt matchar, leder till oönskad skärning utanför målet.
2015, Doudnas labb upptäckte en konformationsomkopplare av Cas9 som aktiveras när RNA-guiden och DNA-målet matchar. De fann att endast när RNA och DNA matchar nära, kommer 3D-strukturen av Cas9, i synnerhet konformationen av HNH-nukleasdomänen, ändra och aktivera saxen i Cas9. Dock, processen som är ansvarig för avkänning av nukleinsyrorna uppströms om konformationsomkopplaren förblev okänd.
I den aktuella studien, Chen och Dagdas använde en teknik som kallas single-molecule FRET (Förster resonance energy transfer) för att exakt mäta hur de olika proteindomänerna i Cas9-sgRNA proteinkomplexet - i synnerhet REC3, REC2 och HNH - rör sig när komplexet binder till DNA.
De fastställde först att specificitetsfördelarna med eSpCas9(1.1) och SpCas9-HF1 kunde förklaras av det faktum att tröskeln för HNH-konformationsväxlingen var mycket högre för dessa Cas9-varianter än för vildtyps-Cas9-proteinet, vilket gör varianterna eSpCas9(1.1) och SpCas9-HF1 mindre benägna att aktivera saxen när de är bundna till en sekvens utanför målet.
Nästa, de avslöjade att REC3-domänen är ansvarig för att känna av noggrannheten av målbindning, som sedan signalerar utåtrotationen av REC2-domänen för att öppna en väg för HNH-nukleasdomänen, aktivera saxen. Denna aktiva konformation av Cas9 kan sedan klyva båda strängarna av mål-DNA:t.
Chen, Dagdas och Kleinstiver visade sedan att genom att mutera delar av REC3, det är möjligt att ändra specificiteten för Cas9-proteinet så att HNH-nukleaset inte aktiveras om inte guide-RNA- och mål-DNA-matchningen är mycket nära. De kunde konstruera en förbättrad hyperexakt Cas9, kallad HypaCas9, som behåller sin måleffektivitet men är något bättre på att skilja mellan platser på och utanför mål i mänskliga celler.
"Om du muterar vissa aminosyrarester i REC3, du kan justera balansen mellan Cas9-aktivitet på målet och förbättrad specificitet; vi kunde hitta den sweet spot där det finns tillräcklig aktivitet vid det avsedda målet men också en stor minskning av händelser utanför målet, " sa Chen.
Genom att fortsätta utforska sambanden mellan strukturer, funktion och dynamik hos Cas9, Doudna och hennes team hoppas kunna vidareutveckla proteinet med utsökt känslighet för att tillförlitligt och effektivt utföra en mängd olika genetiska förändringar.